| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
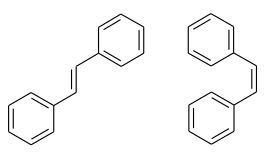
| trans- (links) und cis-Isomer (rechts) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Stilben | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C14H12 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 180,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
| |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Stilben (1,2-Diphenylethen) ist ein ungesättigter Kohlenwasserstoff, der als symmetrisches Diphenylderivat des Ethens gesehen werden kann. Es existieren mit dem cis- und trans-Stilben zwei konfigurationsisomere Verbindungen. Das asymmetrisch substituierte Diphenylderivat des Ethens ist das Konstitutions- bzw. Strukturisomer 1,1-Diphenylethen.
Der Name Stilben stammt 1845 vom französischen Chemiker Auguste Laurent und bezieht sich auf das griechische Wort stilbein für glänzen, ähnlich dem perlmuttglänzenden Mineral Stilbit.[6]
Darstellung und Gewinnung
Die Synthese von trans-Stilben gelingt durch die Umsetzung von Benzaldehyd mit Benzylphosphonsäurediethylester in einer Horner-Wadsworth-Emmons-Reaktion.[8] Der alkylierte Phosphonsäureester kann durch eine Michaelis-Arbuzov-Reaktion von Diethylphosphit mit Benzylbromid erhalten werden.[8]

Eine alternative Herstellvariante ist die Umsetzung von Benzaldehyd mit Benzylmagnesiumbromid.[9] Die technische Herstellung von trans-Stilben erfolgt durch eine katalysierte oxidative Dimerisierung von Toluol oder durch eine reduktive Dimerisierung von Benzylidenchlorid.[6]
Die Herstellung von cis-Stilben erfolgt durch eine photochemische Isomerisierung von trans-Stilben.[10][11][12] Die Isomerisierungsreaktion ist reversibel. Eine Reisomerisierung zum trans-Stilben ist thermisch möglich.[13]

Die Synthese von reinem cis-Stilben gelingt auch durch Metallierung von Diphenylacetylen (Tolan) mit Lithium und anschließender Umsetzung mit Methanol bei −78 °C.[14] Eine weitere Herstellmöglichkeit ist die Decarboxylierung von 2-Phenylzimtsäure.[6]
Eigenschaften
Physikalische Eigenschaften
trans-Stilben bildet farblose glänzende Kristalle, die bei 125 °C schmelzen. Die Schmelzenthalpie beträgt 27,37 kJ·mol−1, die Schmelzentropie 68,8 J·mol−1·K−1.[4] Die molare Wärmekapazität hat bei 25 °C einen Wert von 235,0 J·mol−1·K−1.[4] Für den Feststoff wurde eine molare Verbrennungsenthalpie von −7360,8±3,9 kJ·mol−1 und eine molare Bildungsenthalpie von 136,7 kJ·mol−1 bestimmt.[15][16]
cis-Stilben ist eine farblose Flüssigkeit, die unterhalb des Schmelzpunktes bei 5,85 °C zum Feststoff kristallisiert.[5] Unter einem reduzierten Druck von 13 hPa wurde ein Siedepunkt von 135 °C beobachtet.[6] Die Verdampfungsenthalpie beträgt 66±1 kJ·mol−1.[17] Für die Flüssigkeit wurde eine molare Verbrennungsenthalpie von −7404,05±0,75 kJ·mol−1 bestimmt.[18]
Chemische Eigenschaften
cis-Stilben kann photochemisch zum 4a,4b-Dihydrophenanthren zyklisiert werden.[19] Das Zyklisierungsprodukt ist thermodynamisch instabil und bildet leicht das cis-Stilben zurück.[20] In Gegenwart von Oxidationsmitteln, im einfachsten Fall von Luftsauerstoff, wird schnell das thermodynamisch stabile Phenanthren gebildet.
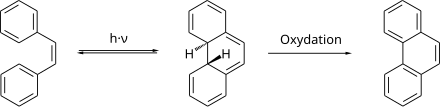
Die Verbindung zersetzt sich bei höheren Temperaturen. Als Zersetzungstemperatur mit dem Kriterium einer Zersetzungsgeschwindigkeit von 1 mol%·h−1 werden 418 °C angegeben.[21]
Verwendung
trans-Stilben kann als Monomerzusatz bei Copolymerisationen eingesetzt werden. Die Kristalle eignen sich als Szintillatormaterialien.[6] cis-Stilben dient oft als olefinische Testsubstanz, um bei organischen Synthesen den Mechanismus und die Stereospezifität aufzuklären. Zudem kann es als Ausgangssubstanz in der Heterocyclensynthese und in Cyclopropanierungen verwendet werden.[6]
Stilbenderivate


Vorkommen
Stilbenderivate werden in Pflanzen gefunden, sie sind Produkt zweier verschiedener Biosynthesewege. Ein Teil stammt aus dem Shikimisäure-Weg, der andere aus der Polyketidbiosynthese, dabei wird ein Phenylpropanidbaustein als Startereinheit für die iterative PKS-Synthese der PKS III verwendet.
Weitere Stilbenderivate sind Resveratrol, welches mit gesundheitsfördernden Wirkungen von Rotwein in Verbindung gebracht wird, Rhaponticin, ein aus Rhabarber isolierbares Phytoestrogen, und Pinosylvin, ein im Kernholz von Kiefern vorkommendes 3,5-Stilbendiol.[9]
Combretastatin A-4 ist ein Naturstoff aus Combretum caffrum, einer Art von südafrikanischen Langfäden.
Verwendung
Eine Reihe von Stilbenderivaten besitzen hormonartige Wirkung. Der Stoff Diethylstilbestrol (Diäthylstilböstrol, DES) war das erste kommerzielle orale Estrogenpräparat. Auf Grund der anabolen Wirkung wurde DES bis Anfang der 1980er-Jahre in der Rinder- und Schweinemast als Masthilfsmittel eingesetzt. Allerdings ist DES krebserregend. Deshalb ist die Anwendung von Stilben und deren Derivaten bei Tieren, die der Lebensmittelgewinnung dienen, in der EU verboten. In Deutschland ist dies gesetzlich in der Verordnung über Stoffe mit pharmakologischer Wirkung geregelt.[22] Im Zusammenhang mit Hormonfleisch-Skandalen wurden diese Stilbenderivate in Medienberichten oft als „Stilbene“ bezeichnet.
Weitere Stilbenderivate, wie Clomifen, Tamoxifen und Toremifen finden Anwendung als Estrogenrezeptormodulatoren.
Stilben-Derivate werden häufig als optische Aufheller, vor allem in Textilien aus Polymerstoffen, sowie als Laserfarbstoffe eingesetzt. Dabei wird die Besonderheit des Stilbens gegenüber anderen Aromaten und Polyenen ausgenutzt, dass es trotz der die Absorption charakterisierenden Doppelbindung fluoresziert. Dies beruht auf der starken Änderung der Bindungsverhältnisse im angeregten Zustand; die Doppelbindung erhält im angeregten S1-Zustand starken Einfachbindungscharakter, die Einfachbindungen zu den Ringen dagegen gewinnen an Doppelbindungscharakter. Dadurch werden die Torsionsschwingungen der Ringe stark abgeschwächt, die bei anderen Verbindungen ähnlicher Struktur starken fluoreszenzlöschenden Charakter haben, woraus die vergleichsweise starke Fluoreszenzquantenausbeute von Stilben resultiert.
Literatur
- Topics in Current Chemistry. Vol. 209. Springer, Berlin 2000, ISBN 3-540-66573-0.
Weblinks
- Friedrich Katscher: Die Kinder des Stilböstrols. In: Wiener Zeitung. 16. Oktober 1998 (abgerufen am 18. November 2013).
Einzelnachweise
- ↑ Datenblatt trans-Stilben bei Merck, abgerufen am 9. Dezember 2010.
- ↑ Datenblatt cis-Stilben bei Merck, abgerufen am 9. Dezember 2010.
- ↑ a b c d CRC Handbook of Chemistry and Physics. 87. Auflage. (CD-Rom Version 2007), Taylor and Francis, Boca Raton (FL) 2007.
- ↑ a b c J. C. van Miltenburg, J. A. Bouwstra: Thermodynamic properties of trans-azobenzene and trans-stilbene. In: The Journal of Chemical Thermodynamics. 16, Nr. 1, 1984, S. 61–65, doi:10.1016/0021-9614(84)90075-2.
- ↑ a b S. Frisch, H. Hippler, J. Troe: UV Absorption Spectra and Formation Rates of Silibene in the High Temperature Kinetics of Benzyl Radicals. In: Zeitschrift für Physikalische Chemie. 188, 1995, S. 259–273, doi:10.1524/zpch.1995.188.Part_1_2.259.
- ↑ a b c d e f g Eintrag zu Stilben. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2014.
- ↑ a b Datenblatt trans-Stilbene, 96% bei Sigma-Aldrich, abgerufen am 26. Februar 2013 (PDF).
- ↑ a b Organikum. 21. Auflage. Wiley-VCH 2001, ISBN 3-527-29985-8.
- ↑ a b Römpp Lexikon Chemie. 10. Auflage, Georg Thieme, 1999.
- ↑ H. Goerner, H. J. Kuhn: Cis-Trans Photoisomerization of Stilbenes and Stilbene-Like Molecules, In: Advances in Photochemistry. 19, 1995, S. 1–117, doi:10.1002/9780470133507.ch1.
- ↑ J. Saltiel, J. T. D’Agostino, E. D. Megarity, L. Metts, K. R. Neuberger, M. Wrighton, O. C. Zafiriow: Org. Photochem. 3, 1973, 1.
- ↑ F.A. Carey, R.J. Sunberg: Advanced Organic Chemistry - Part A: Structure and Mechanisms. 5. Auflage. Springer, 2008, ISBN 978-0-387-68346-1, S. 1085–1091.
- ↑ Carlo Bastianelli, Vincenzo Caia, Giampietro Cum, Raffaele Gallo, Vittorio Mancini: Thermal isomerization of photochemically synthesized (Z)-9-styrylacridines. An unusually high enthalpy of Z→E conversion for stilbene-like compounds. In: Journal of the Chemical Society, Perkin Transactions 2. Nr. 5, 1991, S. 679–683, doi:10.1039/P29910000679.
- ↑ G. Levin, Joseph Jagur-Grodzinski, Michael Szwarc: Simple and quantitative method of preparation of cis-stilbene and its deuterated analog, Ph-CD:CD-Ph. In: The Journal of Organic Chemistry. 35, Nr. 5, 1970, S. 1702–1702, doi:10.1021/jo00830a109.
- ↑ Sidney Marantz, George Thomson Armstrong: Heats of combustion of trans-stilbene and trans-2,2',4,4',6,6'-hexanitrostilbene. In: Journal of Chemical & Engineering Data. 13, Nr. 1, 1968, S. 118–121, doi:10.1021/je60036a036.
- ↑ Sidney Marantz, George T Armstrong: Corrections- Heats of Combustion of trans-Stilbene and trans-2,2',4,4',6,6'-Hexanitrostilbene (HNS). In: Journal of Chemical & Engineering Data. 13, Nr. 3, 1968, S. 455–455, doi:10.1021/je60038a902.
- ↑ D. S. Brackman, P. H. Plesch: Some physical properties of cis-stilbene. In: Journal of the Chemical Society (Resumed). 1952, S. 2188–2190, doi:10.1039/JR9520002188.
- ↑ Keith Yates, Robert S. McDonald: Thermomechanical probe into the mechanism of electrophilic addition to olefins. In: Journal of the American Chemical Society. 93, Nr. 23, 1971, S. 6297–6299, doi:10.1021/ja00752a066.
- ↑ Frank B. Mallory, Clelia W. Mallory: Photochemistry of stilbenes. VI. Steric effects on the photocyclizations of some m-substituted stilbenes. In: Journal of the American Chemical Society. 94, Nr. 17, 1972, S. 6041–6048, doi:10.1021/ja00772a017.
- ↑ Longbin Liu, Bingwei Yang, Thomas J. Katz, Michael K. Poindexter: Improved methodology for photocyclization reactions. In: The Journal of Organic Chemistry. 56, Nr. 12, 1991, S. 3769–3775, doi:10.1021/jo00012a005.
- ↑ I. B. Johns, E. A. McElhill, J. O. Smith: Thermal Stability of Some Organic Compounds. In: Journal of Chemical & Engineering Data. 7, Nr. 2, 1962, S. 277–281, doi:10.1021/je60013a036.
- ↑ Text der Verordnung über Stoffe mit pharmakologischer Wirkung










