Unter Stammzelltransplantation (SZT) versteht man die Übertragung von Stammzellen von einem Spender an einen Empfänger. Dabei kann es sich bei Spender und Empfänger um dieselbe Person handeln (autologe Transplantation) oder um zwei verschiedene Personen (allogene Transplantation).
In der klinischen Praxis werden heute ausschließlich Blutstammzellen transplantiert. Blutstammzellen werden auch als hämatopoetische Stammzellen bezeichnet; daher die ans Englische angelehnte Kurzbezeichnung HSZT (für hämatopoetische Stammzelltransplantation). Im Rahmen von klinischen Studien wurden bereits andere, nicht blutbildende Stammzellen übertragen, etwa mesenchymale Stammzellen. Diese Transplantationen sind jedoch derzeit noch nicht von praktischer Bedeutung für die Medizin (siehe hierzu Regenerative Medizin, Stammzelltherapie etc.). Im Folgenden ist daher nur von der Transplantation von Blutstammzellen die Rede. Es gibt drei verschiedene Transplantationsarten: die allogene, die autologe und die syngene. Die allogene ist die häufigste Transplantationsart, bei der weltweit nach Menschen mit verträglichen Gewebemerkmalen gesucht wird. Bei der autologen Transplantation werden dem Patienten selbst Stammzellen entnommen, und diese dann nach entsprechender myeloablativer (also das Knochenmark zerstörender) Therapie dem Patienten wieder zugeführt. Die syngene ist die seltenste Transplantationsart, da man einen Zwilling des Empfängers finden muss.
Indikation für eine Stammzelltransplantation

Eine autologe Transplantation kann notwendig werden, wenn z. B. aufgrund einer Krebserkrankung eine Chemotherapie und/oder Bestrahlung notwendig wird. Da diese aber das eigene blutbildende System schwer schädigen können, werden dem Patienten vor Beginn der Behandlung gesunde Stammzellen entnommen, die ihm nach der myeloablativen (Knochenmark eliminierenden) Therapie wieder zurückgegeben werden. Die Knochenmarksfunktion kann somit wiederhergestellt werden. Die in den 1970er Jahren eingeführte autologe Stammzelltransplantation machte eine Hochdosis-Chemotherapie, z. B. beim Neuroblastom, erst möglich und erhöhte somit wesentlich die Heilungschancen insbesondere bei kindlichen malignen Tumoren. Eine weitere Anwendung ist die Entnahme von erkrankten Stammzellen zur Behandlung außerhalb des Körpers des Patienten.
Allogene Stammzelltransplantationen werden vor allem bei den verschiedenen Formen der Leukämie eingesetzt, wenn andere Behandlungsmethoden nicht zum Erfolg geführt haben, aber auch bei verschiedenen anderen Erkrankungen wie z. B. malignen Lymphomen. Oftmals ist eine Transplantation für den Patienten die einzige Möglichkeit für eine vollständige Heilung. Beim Hodgkin-Lymphom hingegen ist ein Nutzen der allogenen Stammzelltransplantation nicht belegt.[1]
Auch bei nicht-malignen Erkrankungen kommt die Stammzelltransplantation zum Einsatz: Die ersten erfolgreichen allogenen Stammzelltransplantationen wurden 1968 an Patienten mit den erblichen Immunschwächekrankheiten X-SCID und Wiskott-Aldrich-Syndrom durchgeführt. Bei schweren Hämoglobinopathien wie der Sichelzellkrankheit oder der homozygoten β-Thalassaemia major stellt eine allogene Stammzelltransplantation die einzige kurative Therapieoption dar.[2]
Voraussetzungen für eine erfolgreiche Transplantation
Wichtigste Voraussetzung für eine erfolgreiche (allogene) Transplantation ist die Verfügbarkeit eines kompatiblen Spenders. Hierzu werden bestimmte Gewebemerkmale, die so genannten HLA-Typen, untersucht. Da die Gewebemerkmale durch ihre Vielfalt millionenfache Kombinationen ermöglichen, gestaltet sich die Suche nach dem passenden Spender als überaus schwierig. Je genauer Spender und Empfänger in ihren HLA-Merkmalen übereinstimmen, desto größer ist die Wahrscheinlichkeit einer erfolgreichen Transplantation. Umgekehrt sinkt mit jeder Unstimmigkeit in den HLA-Merkmalen, den so genannten HLA-Mismatches, die Chance auf ein erfolgreiches Anwachsen der transplantierten Zellen und das Risiko für den Patienten steigt. Beispielsweise erhöht sich bei nicht komplett passenden Merkmalen die Wahrscheinlichkeit, an einer so genannten Graft-versus-Host (GvH)-Reaktion zu erkranken, einer Abstoßungsreaktion, bei der die transplantierten Immunzellen des Spenders die Organe des Patienten als fremd erkennen und bekämpfen. Die Auswirkungen einer GvH können zwar meist mit Medikamenten kontrolliert werden, sodass Empfänger leichtes (teils chronisches) Unbehagen spüren können, schwerere GvH-Verläufe können jedoch Organschäden hervorrufen oder zum Tod des Empfängers führen. Mesenchymale Stromazellen könnten zur therapeutischen und prophylaktischen Behandlung von GvH-Reaktionen verwendet werden. Im Jahr 2019 haben Fisher und Mitarbeiter eine Cochrane-Übersichtsarbeit mit randomisierten kontrollierten Studien erstellt, um die Sicherheit und Wirksamkeit von mesenchymalen Stromazellen (MSC) bei Patienten mit einer Graft-versus-Host-Reaktion (GvHD) zu messen. Die Evidenz ist sehr ungewiss bezüglich der Wirkung von mesenchymalen Stromazellen für die Behandlung von Graft-versus-Host Erkrankungen nach Stammzelltransplantationen auf die Vollremission (= komplettes Verschwinden) von akuten und chronischen Graft-versus-Host Reaktionen bei therapeutischer Anwendung. Mesenchymale Stromazellen verursachen eventuell nur eine geringe oder keine Veränderung bezüglich der Gesamtmortalität, der Rückkehr der malignen Erkrankung und der Inzidenz der akuten und chronischen Graft-versus-Host Reaktion bei prophylaktischen Zwecken.[3]
Bei der Spendersuche spielt die (AB0)-Blutgruppe keine wesentliche Rolle – Spender und Empfänger können unter bestimmten Voraussetzungen auch unterschiedliche Blutgruppen besitzen. Da beim Empfänger vor der Transplantation das gesamte erkrankte blutbildende System zerstört und durch die Stammzellen des Spenders neu aufgesetzt wird, hat der Empfänger nach einer erfolgreich verlaufenen Transplantation immer die Blutgruppe des Spenders – auch wenn er vorher eine andere hatte.
Meistens kommen enge Verwandte (Geschwister) am ehesten als Spender in Frage. Für eine Vielzahl von Patienten steht jedoch kein passender Familienspender zur Verfügung – für diesen Fall gibt es seit einigen Jahren entsprechende Datenbanken, in denen die HLA-Merkmale vieler Millionen freiwilliger Spender gespeichert sind. Trotzdem dauert die Suche nach einem passenden Fremdspender meist einige Monate.
Spendersuche und Spenderregister
Nur etwa 30 % aller Patienten, die eine Stammzellspende einer anderen Person benötigen, finden einen geeigneten Spender im eigenen Verwandtenkreis. Die übrigen sind auf einen Fremdspender angewiesen. Für die Vermittlung solcher Spender haben sich weltweit zahlreiche Organisationen gegründet, die eine Knochenmarkspenderdatei betreiben.
Interessierte Spender können sich bei einer dieser Organisationen oder teilweise in Apotheken[4] typisieren lassen, am einfachsten bei einer vor Ort durchgeführten Typisierungsaktion. Dabei wird eine kleine Blutprobe (etwa 2–20 ml, das entspricht maximal etwa zwei Esslöffeln), entnommen oder ein Abstrich von der Wangeninnenwand gewonnen, mit deren Hilfe im Labor die wichtigsten Gewebemerkmale bestimmt werden können. Der Abstrich des Gewebes kann von zu Hause aus durchgeführt werden und über den Versandweg verschickt werden. Diese werden zusammen mit dem Namen und der Anschrift des potentiellen Spenders bei der jeweiligen Organisation gespeichert. Die persönlichen Daten dienen nur dazu, später mit dem Spender Kontakt aufnehmen zu können. In die nationalen und internationalen Datenbanken gelangen alle Informationen nur in anonymisierter Form unter einer Spenderkennziffer. Mit der Aufnahme in ein Spenderregister verpflichtet sich aber noch niemand, später tatsächlich zu spenden.
Bisher sind in Deutschland rund 10 Millionen Spendewillige registriert und HLA-typisiert (Stand: April 2023), weltweit sind es insgesamt 27,7 Millionen (Stand: 27. Januar 2016).[5]
Benötigt ein Patient eine Fremdspende, so richten sich die behandelnden Ärzte an sogenannte Suchzentren, die meist großen Transplantationskliniken oder Spenderdateien angegliedert sind, um eine Spendersuche einzuleiten, in Deutschland handelt es sich dabei im Normalfall um das Zentrale Knochenmarkspender-Register Deutschland.[6] Diese Register suchen in den internationalen Datenbanken nach geeigneten Spendern. Ziel ist es, einen möglichst HLA-kompatiblen Spender zu finden. Allerdings spielen auch andere Faktoren, wie zum Beispiel Alter, Gewicht und Geschlecht der potentiellen Spender eine Rolle, da die verfügbare Anzahl für eine eventuelle Transplantation benötigter Stammzellen auch von diesen Faktoren beeinflusst wird. In Frage kommende Spender werden dann über ihre Spenderdateien gebeten, sich noch einmal Blut abnehmen zu lassen, damit die Verträglichkeit mit dem Patienten genauer bestimmt werden kann (Fein- oder High Resolution-Typisierung).
Mit Hilfe internationaler Spenderegister ist es heute möglich, für etwa 70 % der Bedürftigen, die keinen geeigneten Spender bereits in der Familie haben, diesen genetischen Zwilling zu finden.
Allerdings wirkt es sich für die Spendersuche negativ aus, dass einige Spender bei einem Umzug ihr Spenderegister nicht informieren und sie (z. B. aufgrund des Fehlens von Meldegesetzen, wie etwa in den USA) nicht mehr aufgefunden werden können. Es ist bereits vorgekommen, dass trotz sehr seltener Gewebemerkmale bereits ein geeigneter Spender in den Datenbanken vorhanden war, aber aufgrund eines Umzugs nicht mehr ausfindig gemacht werden konnte.
Ist schließlich ein passender Spender gefunden, so werden dessen Gewebemerkmale noch einmal getestet (sog. Bestätigungstest oder Confirmatory Typing) als auch mittels eines medizinischen Fragebogens sowie virologischen Untersuchungen die Spendefähigkeit beurteilt. Dies geschieht, um alle Risikofaktoren ausschließen zu können, die später den Spender oder den Empfänger gefährden könnten. Die Spenderdateien sind verpflichtet, den Spender über auffällige Befunde (z. B. positive Befunde für Hepatitis- oder HIV-Marker oder seltene Blutmerkmale) zu informieren.[7]
Bis zum Beginn der Vorbehandlung des Patienten (siehe unten) kann der Spender jederzeit noch von der Spende zurücktreten. Nach Möglichkeit sollte dies zu einem so späten Zeitpunkt jedoch vermieden werden, da bis dahin bereits viel Zeit und Geld in die Spendersuche investiert worden ist. Ein Zurücktreten kurz vor der eigentlichen Spende (das heißt, wenn der Patient bereits vorbehandelt wird) führt in den meisten Fällen zum Tod des Patienten, da die Vorbehandlung oftmals mit erheblichen Komplikationen einhergeht, die der Körper nur selten ohne das Transplantat bewältigen kann.
Grundsätzlich bekommen Spender ab dem Zeitpunkt, an dem sie um einen erneuten Bluttest gebeten werden, alle notwendigen Auslagen erstattet. Dies schließt die Fahrtkosten zu Voruntersuchungen und zur Spende selbst sowie den Verdienstausfall für diese Tage mit ein. Bei Arbeitnehmern wird üblicherweise der Lohn weitergezahlt, und der Arbeitgeber kann der jeweiligen Spenderdatei diesen Betrag in Rechnung stellen. Zudem werden für die Spender von den meisten Dateien Versicherungen abgeschlossen, die Zwischenfälle bei den Voruntersuchungen und der eigentlichen Entnahme sowie Unfälle bei Fahrten zu diesen Terminen abdecken.
Während des gesamten Spendevorgangs erfahren weder der Empfänger oder seine Ärzte die Identität des Spenders, noch weiß der Spender, wer der Patient ist (dies gilt natürlich nicht für Spenden unter Familienangehörigen). Etwa sechs bis acht Wochen nach der Transplantation kann der Spender sich über seine Spenderdatei über den Gesundheitszustand des Empfängers informieren. Da das Transplantat eine Zeit braucht, um anzuwachsen, kann man vorher keine sicheren Auskünfte geben. Aber auch nach dieser Zeitspanne sind endgültige Aussagen schwierig, da selbst nach gelungener Transplantation Rückfälle der Erkrankungen auftreten können. Ist aber alles gut gegangen, ist in vielen Fällen auch Kontakt mit dem Patienten bzw. dem Spender möglich. Abhängig von den Richtlinien des jeweiligen Spender- beziehungsweise Patientenregisters, können sich der Spender und sein Empfänger nach einer gewissen Zeit entweder anonyme Briefe über die Spenderdatei beziehungsweise das Transplantationszentrum schicken oder nach einer gewissen Zeit auch persönlich kennenlernen, wenn beide dies wünschen. Bei deutschen Patienten beträgt die Zeit zwischen letzter Transplantation und persönlichem Kennenlernen zwei Jahre. Es gibt aber auch Länder, in denen ein solches Kennenlernen grundsätzlich nicht möglich ist.
Methoden der Stammzellgewinnung
Grundsätzlich gibt es derzeit zwei Methoden der Stammzellgewinnung, die klassische Knochenmarksentnahme und die inzwischen üblichere Periphere Blutstammzellspende. Mit beiden Methoden erreicht man qualitativ gleichwertige Ergebnisse. Der Spender hat allerdings keine Möglichkeit, das Entnahmeverfahren selbst zu wählen, da dieses vom Ärzteteam des Empfängers unter Berücksichtigung individueller gesundheitlicher Aspekte gewählt wird. Typischerweise wird in ca. 80–90 % der Fälle die Periphere Blutstammzellspende gewählt.
Daneben besteht mit gewissen Einschränkungen die Möglichkeit, Stammzellen (Nabelschnurblutstammzellen) aus Nabelschnurblut zu gewinnen.
Die Entnahme des Transplantats muss nicht zwangsläufig in der Klinik stattfinden, in der der Patient behandelt wird; vielmehr wird von den Spenderdateien versucht, eine Entnahme in der Nähe des Wohnortes des Spenders zu organisieren, damit dieser keine weite Reise zu unternehmen braucht. Das Transplantat wird am selben Tag von einem Kurier (meist der behandelnde Arzt des Patienten oder ein Mitarbeiter der Klinik) zum Patienten gebracht.
Knochenmarkspende
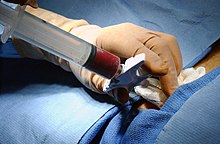

Die klassische Methode der Stammzelltransplantation ist die Übertragung von rotem Knochenmark. Dem Spender wird dabei in der Regel aus dem Beckenkamm durch eine spezielle Nadel etwa 1 Liter Knochenmark-Blut-Gemisch entnommen. Die Stammzellen werden hieraus isoliert und ggf. weiter aufgereinigt und dem Empfänger später transfundiert.
Die Prozedur der Entnahme erfolgt unter Narkose und dauert inklusive Ein- und Ausleitung der Narkose etwa 1 bis 1½ Stunden. Obwohl auch ambulante Entnahmen möglich sind, wird der Spender meist am Vorabend der Entnahme stationär aufgenommen und am Tag nach der Entnahme wieder entlassen, um noch eine Kontrollnacht nach Narkose und Entnahme zu haben. Das entnommene Knochenmark regeneriert sich beim Spender innerhalb von etwa zwei Wochen; oft werden zur Unterstützung der Blutbildung Eisentabletten mit nach Hause gegeben.
Periphere Blutstammzellspende
Inzwischen wurde die klassische Knochenmarkspende von der Peripheren Blutstammzellspende weitgehend abgelöst. Dabei wird dem Spender etwa eine Woche lang das Hormon G-CSF gespritzt, welches bewirkt, dass Stammzellen aus dem Knochenmark ins Blut übergehen. Dort können sie dann mittels Stammzellapherese herausgefiltert werden (genauere Beschreibung siehe dort).
Nabelschnurblutspende
Eine besondere Form der Stammzelltransplantation ist die Verwendung von Nabelschnurblut. Direkt nach der Geburt wird aus der abgeklemmten Nabelschnur das dort befindliche Blut abgesaugt (es würde sonst weggeworfen) und im Labor die Stammzellen extrahiert. Die so gewonnenen Stammzellen sind besonders gut verträglich, stehen aber naturgemäß nur in geringerer Menge zur Verfügung. Eltern können Nabelschnurblut ihrer Kinder spenden oder kostenpflichtig zum eigenen Gebrauch einfrieren lassen.
Risiken für den Spender
Wie jeder medizinische Eingriff ist eine Stammzelltransplantation auch für den Spender mit möglichen Risiken und Nebenwirkungen verbunden, die durch den invasiven Eingriff und die verabreichten Medikamente hervorgerufen werden können. Vor jeder Stammzellspende findet eine umfassende Gesundheitsprüfung statt, wodurch die möglichen Risiken der Transplantation so gering wie möglich gehalten werden. Ausschlussgründe sind z. B. ein Alter über 61 Jahre, Herz-Kreislauf-Erkrankungen, Autoimmunerkrankungen, Erkrankungen der Niere sowie Infektionskrankheiten. Auch psychische Erkrankungen und das Vorliegen einer Suchtkrankheit führen in aller Regel zum Ausschluss. Dadurch wird sichergestellt, dass nur gesunde und widerstandsfähige Spender herangezogen werden und potenzielle Risikofaktoren bereits im Voraus ausgeschlossen werden können.[8][9]
Generell gilt die Stammzelltransplantation für den Spender als ein relativ risikoarmer Eingriff. Trotzdem kann es bei der Durchführung zu Komplikationen kommen, wobei in seltenen Fällen auch schwere und dauerhafte Schädigungen dokumentiert sind. In sehr seltenen Einzelfällen wurde auch über Todesfälle nach einer Stammzellenspende berichtet.[10]
Knochenmarkspende
Die möglichen Nebenwirkungen für den Knochenmarkspender beschränken sich in der Regel auf leichte Schmerzen und Bewegungseinschränkungen (ähnlich einem Muskelkater) sowie Hämatome im Bereich der Einstichstellen, die jedoch nach einigen Tagen wieder verschwinden. Durch die notwendige Narkose kann es unter Umständen auch zu vorübergehender Übelkeit o. ä. kommen. Das Risiko, dass es durch die Narkose oder durch das Punktieren des Knochenmarkraumes zu ernsten Komplikationen kommt, liegt laut dem US-Gesundheitsministerium etwa bei 2,4 %.[11] Bei 99 % aller Spender kommt es jedoch zu einer vollständigen Erholung.[12] Einer Studie zufolge ereignete sich bei den teilnehmenden europäischen Transplantationsteams im Zeitraum von 1993 bis 2005 ein einziger Todesfall bei einer Gesamtzahl von 27.770 durchgeführten Knochenmarkspenden. Gegenüber der Normalbevölkerung wurde in einem Zeitraum von mehreren Jahren nach dem Eingriff keine erhöhte Krebsgefahr festgestellt.[13]
Häufig wird im Zusammenhang mit einer Stammzelltransplantation der Begriff Knochenmark mit Rückenmark verwechselt. Dies ist jedoch falsch; bei einer Knochenmarkentnahme wird kein Eingriff an der Wirbelsäule vorgenommen. Einschränkungen der Empfindungsfähigkeit oder gar eine Querschnittlähmung sind daher grundsätzlich nicht zu befürchten.
Periphere Blutstammzellspende
Als Nebenwirkungen treten beim Spender oft mehr oder weniger stark ausgeprägte grippeähnliche Symptome auf, die durch das verabreichte Medikament (z. B. Filgrastim) verursacht werden und nach dessen Absetzung in aller Regel schnell wieder verschwinden. Einer Studie mit 2408 Spendern zufolge berichten 40 % der Patienten nach dem Eingriff über Müdigkeit, Kopfschmerzen und Schlaflosigkeit. Diese Symptome verschwinden in der Regel im Verlauf von einem Monat. Empfundene Knochenschmerzen gehen bei 94 % der Patienten innerhalb von einer Woche zurück. Allerdings waren bis zu 2 % der Patienten auch ein Jahr nach dem Eingriff noch nicht vollständig schmerzfrei. Durch die gleichzeitige Gabe gängiger, frei verkäuflicher Schmerzmittel wie z. B. von Paracetamol oder Ibuprofen können diese Symptome oft stark gelindert werden. Etwa zwei Drittel der Patienten mit mittelschweren bis starken Schmerzen sprechen auf diese Schmerzmedikamente an. 3 % der Spender berichteten über dauerhafte Müdigkeit, die auch längere Zeit nach dem Eingriff noch fortbestand. Bei 15 von 2408 Spendern (0,6 %) ergaben sich schwere Komplikationen mit der Notwendigkeit eines längeren stationären Krankenhausaufenthalts. Todesfälle traten in dieser Studie jedoch nicht auf. Auch die Krebsraten der Spender waren in einem Zeitraum von 8 Jahren nach dem Eingriff im Vergleich zur Normalbevölkerung nicht erhöht.[14]
Das Risiko ernster Herz-Kreislauf-Probleme nach dem Eingriff liegt gemäß einer Befragung von 262 Stammzellentransplantationsteams in europäischen Fachkliniken bei etwa 1:1500. In dieser Studie wurde bei einer Gesamtanzahl von 23.254 vollzogenen peripheren Blutstammzellspenden von 4 Todesfällen berichtet. Die Anzahl der Krebsfälle nach dem Eingriff war auch hier gegenüber der Normalbevölkerung über einen mehrjährigen Betrachtungszeitraum nicht erhöht.[15]
Nabelschnurblutspende
Das Abklemmen und Abtrennen der Nabelschnur nach der Geburt ist ein notwendiger und natürlicher Vorgang bei der Geburt eines Kindes. Bei einer komplikationsfreien Geburt wird die Nabelschnur erst getrennt, wenn das Blut vollständig auspulsiert ist, d. h. dem Kreislauf des Neugeborenen einverleibt wurde. Auf das Auspulsieren kann im Rahmen einer beabsichtigten Spende verzichtet werden. Da beim normalen Geburtsvorgang also kein zusätzlicher medizinischer Eingriff notwendig ist, ist die Nabelschnurblutspende daher nach derzeitigem Kenntnisstand für Mutter und Kind risikofrei.[16]
Ablauf der Transplantation beim Empfänger
Grundsätzlich werden die gewonnenen Stammzellen dem Patienten intravenös übertragen. Dazu muss jedoch zunächst das eigene, kranke Knochenmark mit Bestrahlungen und/oder Chemotherapie zerstört werden. Diese Phase der Vorbereitung wird als Konditionierung bezeichnet. Je gründlicher dies geschieht, desto schwerer sind die Nebenwirkungen, aber desto geringer ist die Gefahr eines Rückfalls. Die Entscheidung über die Intensität der Vorbehandlung treffen die behandelnden Ärzte. Die verbleibenden Reste des alten Knochenmarks werden dann vom neuen Immunsystem, das vom Spender stammt, zerstört. Aus diesem Grund sind eineiige Zwillingsgeschwister nicht unbedingt die idealen Spender: zwar ist hier die Verträglichkeit der übertragenen Stammzellen besonders gut, aber möglicherweise werden die Reste des kranken Knochenmarks nicht vollständig beseitigt. Gleiches gilt für autologe Transplantationen.
Die eigentliche Transplantation ist unaufwändig: das Transplantat wird direkt aus dem Beutel (s. Bild) über einen Venenkatheter in den Blutkreislauf des Empfängers übertragen. Das neue Knochenmark findet selbst den Weg in den Knochen und fängt nach etwa zehn Tagen mit der Produktion der Blutzellen an.
Nach der Transplantation ist der Patient erhöhter Ansteckungsgefahr ausgesetzt. Dies liegt zum einen an der notwendigen Immunsuppression und zum anderen daran, dass zwar das Immunsystem des Spenders in den neuen Körper übertragen wird, aber nicht die Informationen über bereits durchgestandene Krankheiten. Das Immunsystem des Patienten entspricht quasi wieder demjenigen eines Säuglings, und tatsächlich erkranken viele Stammzellempfänger in der Folge an typischen Kinderkrankheiten, auch wenn sie diese schon einmal hatten. Erst nach einigen Jahren entsprechen die Abwehrkräfte wieder denjenigen eines gesunden Erwachsenen.
Eine Stammzelltransplantation kostet in Deutschland rund 98.000 Euro (Stand: 2012).[17]
Stammzelltransplantation mit reduzierter Konditionierung
Bei der klassischen allogenen SZT werden während der Konditionierung mehrere Medikamente in hoher Dosierung, in der Regel kombiniert mit einer Ganzkörperbestrahlung, eingesetzt, um sämtliche leukämischen beziehungsweise bösartigen Zellen auszurotten und das Immunsystem zu unterdrücken. Verbunden damit ist eine Zerstörung des Knochenmarks. Deshalb bezeichnet man diese Art der SZT auch als myeloablativ (knochenmarkzerstörend).
Die Stammzelltransplantation mit reduzierter Konditionierungsintensität (RIC) zielt dagegen im Wesentlichen nur auf eine Immunsuppression mit entsprechenden Immunsuppressiva, um das Immunsystem vor der Transplantation auszuschalten, damit das Risiko des Nichtanwachsens oder einer Abstoßung der transplantierten Spenderstammzellen möglichst klein gehalten wird. Diese Art der Transplantation ist weniger aggressiv. Nach dem Anwachsen der Spenderstammzellen sollen diese dann in der Lage sein, noch vorhandene leukämische Zellen mit Hilfe einer immunologischen Reaktion, der sogenannten Transplantat-Gegen-Leukämie-Reaktion, zu zerstören. Der Vorteil der RIC-SZT liegt darin, dass damit auch ältere Patienten und Patienten mit einer fortgeschrittenen oder schwer heilbaren leukämischen Erkrankung geheilt werden können. Da dieses Verfahren noch relativ jung ist, kann zur Zeit der Stellenwert dieser Art der Übertragung im Vergleich zur klassischen Stammzelltransplantation noch nicht genau erfasst werden. Lebensbedrohliche Komplikationen, wie bei der klassischen SZT, treten allerdings oftmals in gleicher Intensität auf. Dies sind insbesondere schwere Infektionen und die Transplantat-Gegen-Wirt-Reaktion (GvHD), die relativ spät nach der Transplantation auftreten und sich außerdem chronisch entwickeln kann.
In einer Studie des Fred-Hutchinson-Krebszentrums in Seattle (USA) wurde 2011 das Therapieergebnis bei älteren Patienten mit fortgeschrittenen hämatologischen Krebserkrankungen untersucht, die eine allogene Stammzelltransplantation mit reduzierter Konditionierung erhielten. Von 1998 bis 2008 wurden 372 Patienten im Alter von 60–75 Jahren (Durchschnittsalter 64 Jahre) aus 18 Kliniken erfasst. Die Fünfjahresüberlebensrate lag etwa bei einem Drittel der Patienten. Krankheitsfortschritt oder Rückfall war bei 135 Patienten (36 %) die häufigste Todesursache. 104 Patienten (28 %) starben an anderen Ursachen, wie Infektionen, Spender-gegen-Wirt-Reaktion (GvHD) und Multiorganversagen.[18]
Nach einer deutschen Studie aus dem Jahr 2012 wurden 195 Patienten, die an AML erkrankt waren, entweder intensiv oder mit einer niedrigen Dosierung vorbehandelt. Annähernd gleich blieb die Überlebensrate der Patienten nach drei Jahren, sie betrug in beiden Gruppen etwa 60 Prozent. Deutliche Unterschiede zeigten sich hingegen in der Frühphase: Bei der reduzierten Konditionierung waren ein Jahr nach Behandlungsbeginn nur 8 Prozent der Patienten, im Schema mit hochdosierter Vorbehandlung aber 17 Prozent verstorben. Das Alter der erfassten Patienten lag zwischen 18 und 60 Jahren.[19]
Forschung mit Breitenwirkung
Die Stammzellforschung in Deutschland zielt auch darauf ab, Transplantationen bei älteren Krebspatienten zu verbessern. So finanzierte 2011 die Deutsche Krebshilfe sieben Forschungsprojekte eines Schwerpunktprogramms mit 3,2 Millionen Euro, damit die Therapie von Krebs-Patienten im höheren Lebensalter effektiver wird.
Siehe auch
- Zentrales Knochenmarkspender-Register Deutschland
- Deutsche Knochenmarkspenderdatei
- Aktion Knochenmarkspende Bayern
- Stefan-Morsch-Stiftung
- Deutsche José Carreras Leukämie-Stiftung
- Deutsche Stammzellspenderdatei
- Nuklearkatastrophe von Tschernobyl#Weitere Länder
Literatur
- Susanne Schäfer: Menschheits-Geschwister. Erfahrungsbericht einer Knochenmarkspenderin. Glaré-Verlag, Frankfurt 2009. ISBN 978-3-930761-69-2.
- Paul Paulson In Vivo – Diagnose Lymphknotenkrebs: erforscht und durchlebt, Prof. Dr. Michael Hummel Koautor zum onkologischen Hintergrund. Epubli Verlag, 2012. ISBN 978-3-8442-1843-5
Weblinks
Quellen und weitere Informationen zur Stammzellspende und -transplantation:
- Zentrales Knochenmarkspenderregister Deutschland (Zentrales, anonymisiertes Register aller deutschen Spender)
- Deutsche Stammzellspenderdatei DSD
- Österreichisches Rotes Kreuz
- Österreichisches Stammzell-Register
- Schweizer Stiftung Blut-Stammzellen
- Deutsche José Carreras Leukämie-Stiftung e. V.
- zellux.net: Umfangreiches Themenportal mit Unterrichtsmaterial zum Thema Stammzellforschung
- DLH: Stammzellentransplantation mit reduzierter Konditionierung
- Verein für Knochenmark- und Stammzellspenden e. V.
Einzelnachweise
- ↑ Deutsches Ärzteblatt, 28. September 2010: Nutzen der allogenen Stammzelltransplantation bei Hodgkin nicht belegt ( des vom 21. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Guido Lucarelli, Antonella Isgrò, Pietro Sodani, Javid Gaziev: Hematopoietic stem cell transplantation in thalassemia and sickle cell anemia. In: Cold Spring Harbor Perspectives in Medicine. Band 2, Nr. 5, Mai 2012, ISSN 2157-1422, S. a011825, doi:10.1101/cshperspect.a011825, PMID 22553502, PMC 3331690 (freier Volltext).
- ↑ Sheila A Fisher, Antony Cutler, Carolyn Doree, Susan J Brunskill, Simon J Stanworth: Mesenchymal stromal cells as treatment or prophylaxis for acute or chronic graft-versus-host disease in haematopoietic stem cell transplant (HSCT) recipients with a haematological condition. In: Cochrane Database of Systematic Reviews. 30. Januar 2019, doi:10.1002/14651858.CD009768.pub2.
- ↑ Carolin Bauer: Apotheken vermitteln Stammzellen-Spender. Abgerufen am 11. Juli 2016.
- ↑ aktuelle Spenderzahlen ZKRD ( des vom 21. Januar 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Über das ZKRD
- ↑ Deutsche Standards für die nichtverwandte Blutstammzellspende, hier Absatz 3.3(.9). Archiviert vom am 30. März 2018; abgerufen am 9. September 2023.
- ↑ Zentrales Knochenmarkspender-Register Deutschland: Risiken einer Spende, abgerufen am 2. September 2017.
- ↑ WSZE: Ausschlussgründe für Stammzellspenden, abgerufen am 2. September 2017.
- ↑ D. Pamphilon, S. Siddiq, S. Brunskill, C. Dorée, C. Hyde, M. Horowitz, S. Stanworth: Stem cell donation–what advice can be given to the donor? In: British Journal of Haematology. Band 147, Nummer 1, Oktober 2009, S. 71–76, doi:10.1111/j.1365-2141.2009.07832.x, PMID 19681886, PMC 3409390 (freier Volltext) (Review).
- ↑ FAQ des US-Gesundheitsministeriums zur Knochenmarkspende, abgerufen am 23. September 2017.
- ↑ Donor safety and support, abgerufen am 23. September 2017.
- ↑ J. Halter, Y. Kodera, A. U. Ispizua, H. T. Greinix, N. Schmitz, G. Favre, H. Baldomero, D. Niederwieser, J. F. Apperley, A. Gratwohl: Severe events in donors after allogeneic hematopoietic stem cell donation. In: Haematologica. Band 94, Nummer 1, Januar 2009, S. 94–101, doi:10.3324/haematol.13668, PMID 19059940, PMC 2625420 (freier Volltext).
- ↑ M. A. Pulsipher, P. Chitphakdithai, J. P. Miller, B. R. Logan, R. J. King, J. D. Rizzo, S. F. Leitman, P. Anderlini, M. D. Haagenson, S. Kurian, J. P. Klein, M. M. Horowitz, D. L. Confer: Adverse events among 2408 unrelated donors of peripheral blood stem cells: results of a prospective trial from the National Marrow Donor Program. In: Blood. Band 113, Nummer 15, April 2009, S. 3604–3611, doi:10.1182/blood-2008-08-175323, PMID 19190248, PMC 2668845 (freier Volltext).
- ↑ J. Halter, Y. Kodera, A. U. Ispizua, H. T. Greinix, N. Schmitz, G. Favre, H. Baldomero, D. Niederwieser, J. F. Apperley, A. Gratwohl: Severe events in donors after allogeneic hematopoietic stem cell donation. In: Haematologica. Band 94, Nummer 1, Januar 2009, S. 94–101, doi:10.3324/haematol.13668, PMID 19059940, PMC 2625420 (freier Volltext).
- ↑ Nabelschnurblutspende: Helfen ohne Risiko, abgerufen am 2. September 2017.
- ↑ Was Gesundheit kostet ( vom 12. Dezember 2013 im Internet Archive). In: fit!, Nr. 4, 2013, S. 25.
- ↑ newswise 1. November 2011
- ↑ The Lancet Oncology, Oktober 2012: Reduced-intensity conditioning versus standard conditioning before allogeneic haemopoietic cell transplantation in patients with acute myeloid leukaemia in first complete remission: a prospective, open-label randomised phase 3 trial








