| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
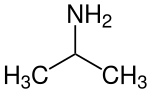
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Isopropylamin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H9N | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit aminartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 59,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,69 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
32 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,3746[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−112,3 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Isopropylamin ist eine organisch-chemische Verbindung aus der Stoffgruppe der primären Amine. Es ist ein vielseitiges Zwischenprodukt für zahlreiche Anwendungen in der Agro- sowie Pharmachemie.
Gewinnung und Darstellung
Die technische Herstellung von Isopropylamin erfolgt durch die Umsetzung von Isopropanol mit Ammoniak bei Temperaturen von 180–220 °C und Drücken von 30–60 bar in Gegenwart von Wasserstoff an Kupfer-, Nickel- und Cobaltoxid-Katalysatoren, welche auf Aluminiumoxid (Al2O3) geträgert sind.[7]
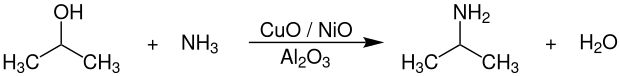
Die Reaktion wird dabei bevorzugt in der Gasphase durchgeführt und erfolgt kontinuierlich. Der Heterogen-Katalysator ist als Festbett in einem Rohr- oder Rohrbündelreaktor angeordnet. Als Nebenprodukte fallen neben Wasser noch geringe Mengen an Diisopropylamin (DIPA) an. Die Aufarbeitung und Reinigung des Produktgemisches erfolgt durch Destillation bzw. Rektifikation. Sowohl der Umsatz als auch die Selektivität betragen über 90 % bezogen auf Isopropanol.[7]
Die reduktive Aminierung von Aceton mit Ammoniak führt ebenfalls zu Isopropylamin.[3]
Eigenschaften
Physikalische Eigenschaften
Isopropylamin hat eine relative Gasdichte von 2,04 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,65 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Die Dichte beträgt 0,69 g/cm3 bei 20 °C. Außerdem weist Isopropylamin einen Dampfdruck von 633 hPa bei 20 °C, 943 hPa bei 30 °C, 1,360 bar bei 40 °C und 3,580 bar bei 65 °C auf. Die dynamische Viskosität beträgt 0,36 mPa·s bei 20 °C.[2]
Chemische Eigenschaften
Monoisopropylamin ist eine organisch-chemische Verbindung aus der Stoffgruppe der aliphatischen primären Amine. Wässrige Lösungen reagieren hierbei stark alkalisch. Isopropylamin zieht aus der Luft Wasser und Kohlenstoffdioxid an. Bei 20 °C hat eine wässrige Lösung mit einer Konzentration von 700 g/l einen pH-Wert von 13.[2] Mit starken Säuren reagiert Isopropylamin stark exotherm. Mit nitrosierenden Verbindungen kann es zur Bildung von krebserzeugenden N-Nitrosaminen kommen.[3]
Verwendung
Isopropylamin ist ein vielseitiges Zwischenprodukt zur Herstellung von Farbstoffen, Gummichemikalien, Pharmazeutika wie Betablockern, Antihypertonika, Antiasthmatika, Anti-Glaukom-Medikamenten, Insektiziden, Emulgatoren und Detergenzien.[3] Es findet außerdem Verwendung bei der Herstellung von Glyphosat, Atrazin und anderen Triazin-Herbiziden. Des Weiteren findet Isopropylamin Verwendung bei der Synthese von Tensiden, Lösungsmitteln, sowie Pharma-Wirkstoffen. Die Salze von Isopropylamin werden als Puffersubstanzen, Korrosionsinhibitoren sowie Treib- und Schmierstoffzusätze eingesetzt.
Sicherheitshinweise
Isopropylamin ist eine extrem entzündbare und leicht flüchtige Flüssigkeit aus der Stoffgruppe der aliphatischen Amine. Die Dämpfe bilden mit Luft explosive Gemische. Wässrige Lösungen reagieren stark alkalisch. Von diesem Stoff gehen akute und chronische Gesundheitsgefahren aus.[2] Die Dämpfe und die Flüssigkeit reizen Atemwege, Schleimhäute und die Haut stark. Bei längerer Exposition kann es zu schweren Verätzungen kommen und ein verschlechtertes Allgemeinbefinden, Atemstörungen, Apathie sowie Gleichgewichtsstörungen auftreten. Bei Inhalation sind Atemstörungen, Tränenfluss, Nasensekretion, Speichelfluss, Hyperaktivität, Verlangsamung der Atmung (Bradypnoe) und nach der Exposition, Verkrustungen um Nase und Augen wahrscheinlich. Es bestehen narkotische Wirkungen und die Gefahr der Bildung von Lungenödeme. Auch Nierenschäden sind möglich.
Einzelnachweise
- ↑ Eintrag zu ISOPROPYLAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Isopropylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Januar 2019. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu Propylamine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Januar 2019.
- ↑ Eintrag zu Isopropylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. Januar 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-31-0 bzw. 2-Aminopropan), abgerufen am 29. September 2019.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ a b Patent EP2782898B1: Verfahren zur Herstellung von Ethylaminen und Mono-iso-propylamin (MIPA). Veröffentlicht am 21. Oktober 2015, Anmelder: BASF SE, Erfinder: Norbert Asprion, Manfred Julius, Oliver Bey, Stefanie Werland, Frank Stein, Matthias Kummer, Wolfgang Mägerlein, Johann-Peter Melder, Kevin Huyghe, Maarten Moors.











