| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
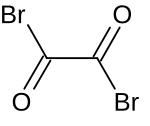
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Oxalylbromid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2Br2O2 | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 215,83 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
2,3 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Brechungsindex |
1,522 (20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Oxalylbromid ist eine chemische Verbindung aus der Stoffgruppe der Carbonsäurebromide. Es ist das Disäurebromid der Oxalsäure.
Gewinnung und Darstellung
Die Synthese von Oxalylbromid durch Reaktion von Oxalylchlorid mit Bromwasserstoff wurde im Jahr 1913 von Hermann Staudinger und Eugen Anthes beschrieben.[2][3] Es ist eine einfachere Alternative mit hoher Ausbeute unter Verwendung von Bromtrimethylsilan bekannt.[4]
Eigenschaften
Oxalylbromid ist eine dunkelgelbe Flüssigkeit.[1] Im reinen Zustand ist sie gelbgrün, nimmt in Licht infolge von Bromausscheidung eine rötlich gelbe bis braune Farbe an. Sie zersetzt sich außerordentlich leicht bei Kontakt mit Wasser und zerfällt dabei in Kohlenstoffmonoxid, Kohlenstoffdioxid und Bromwasserstoff.[2] Oxalylbromid kommt in zwei konformeren Strukturen vor.[5] Dabei liegt sie in der Gasphase als Gemisch beider Formen, in fester Form jedoch nur in der gestaffelte Form vor.[6] Festes Oxalylbromid kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/c (Raumgruppen-Nr. 14) mit den Gitterparametern a = 6,18 Å; b = 5,46 Å, c = 7,80 Å und β = 112,4 ° sowie 2 Formeleinheiten pro Elementarzelle.[7] Oxalylbromid reagiert mit Aromaten, indem es diese in Abwesenheit von Katalysatoren an den Kohlenstoffatomen substituiert, an denen der Index der freien Valenz am höchsten ist.[8] So reagiert es zum Beispiel mit Benzaldehyd, Dibenzalaceton, Dimethylanilin, Michlers Keton und anderen Verbindungen.[2]
Verwendung
Oxalylbromid wird als Zwischenprodukt bei Synthesen (zum Beispiel der Umwandlung von 1,3-Cyclopentandion in 3-Bromcyclopenten-2-on) verwendet.[1] Die Verbindung wird auch für die Herstellung von anderen Säurebromiden aus Carbonsäuren oder Salzen, für weitere Bromierungen und Hydrobromierungen, sowie für Friedel-Crafts-Reaktionen verwendet.[4] So kann Oxalylbromid als Ausgangsstoff für die Herstellung anderer Carbonsäurebromide verwendet werden, indem es mit dem Natriumsalz der entsprechenden Säure umgesetzt wird. Beispielsweise ergibt die Umsetzung von Natriumbenzoat mit Oxalylbromid als Produkt Benzoylbromid. In ähnlicher Weise können auch andere Carbonsäurebromide wie Zimtsäurebromid oder Phenylacetylbromid hergestellt werden. Die Umsetzung von Oxalylbromid mit Carbonsäuren ergibt Carbonsäureanhydride. Beispielsweise kann Benzoesäure zu Benzoesäureanhydrid umgesetzt werden.[9] Oxalylbromid eignet sich als Syntheseäquivalent für Bromwasserstoff für Hydrobromierungen von Alkinen. Dabei wird Bromwasserstoff in situ gebildet. Als Produkte werden insbesondere Dibromalkane erhalten.[10]
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i j Datenblatt Oxalylbromid, 97% bei Sigma-Aldrich, abgerufen am 18. September 2023 (PDF).
- ↑ a b c d Eugen Anthes: Ueber Oxalylbromid und andere Säurehaloide: Reaktionen des Diphenylenketens. 1913, doi:10.3929/ethz-a-000093165.
- ↑ H. Staudinger, E. Anthes: Oxalylchlorid. V.: Über Oxalylbromid und Versuche zur Darstellung von Di‐Kohlenoxyd. In: Berichte der deutschen chemischen Gesellschaft. Band 46, Nr. 2, 1913, S. 1426–1437, doi:10.1002/cber.19130460222.
- ↑ a b Michael D. Ennis, William S. Bechara: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2012, ISBN 978-0-471-93623-7, Oxalyl Bromide, doi:10.1002/047084289x.ro014.pub2.
- ↑ Gyusung Chung, Younghi Kwon: Molecular structures of gauche and anti conformers for oxalyl bromide: ab initio and DFT calculations. In: Chemical Physics Letters. Band 333, Nr. 1, 2001, S. 189–194, doi:10.1016/S0009-2614(00)01333-6.
- ↑ Molecular Structure by Diffraction Methods. Royal Society of Chemistry, 1975, ISBN 978-0-85186-527-0, S. 70 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P. Groth, O. Hassel, Chr. Römming, A. Block-Bolten, J. M. Toguri, H. Flood: Crystal Structures of Oxalyl Bromide and Oxalyl Chloride. In: Acta Chemica Scandinavica. Band 16, 1962, S. 2311–2317, doi:10.3891/acta.chem.scand.16-2311.
- ↑ S. Hauptmann, S. Hartig: Über den Mechanismus der Reaktion von Oxalylbromid mit Aromaten in Abwesenheit von Katalysatoren. In: Journal für Praktische Chemie. Band 20, Nr. 3-4, 1963, S. 197–201, doi:10.1002/prac.19630200312.
- ↑ Roger Adams, L. H. Ulich: THE USE OF OXALYL CHLORIDE AND BROMIDE FOR PRODUCING ACID CHLORIDES, ACID BROMIDES OR ACID ANHYDRIDES. III. In: Journal of the American Chemical Society. Band 42, Nr. 3, März 1920, S. 599–611, doi:10.1021/ja01448a024.
- ↑ Paul J. Kropp, Scott D. Crawford: Surface-Mediated Reactions. 4. Hydrohalogenation of Alkynes. In: The Journal of Organic Chemistry. Band 59, Nr. 11, Juni 1994, S. 3102–3112, doi:10.1021/jo00090a031.










