Multienzymkomplexe sind Gruppen von Enzymen, die aufeinanderfolgende Schritte im Metabolismus der Zelle katalysieren und miteinander assoziiert sind. Alle Organismen nutzen dieses Prinzip, das einen wichtigen Schritt bei der Verbesserung der katalytischen Effizienz darstellt. Die Vorteile sind offensichtlich:
- enzymatische Umsetzungen sind durch Diffusionsvorgänge limitiert, d. h. durch die Häufigkeit, mit der Enzyme auf ihre Substrate treffen. In Multienzymkomplexen wird die Distanz, die ein Reaktionsprodukt (das ist das Substrat der nachfolgenden Reaktion) zurücklegen muss, minimiert, da die Reaktionszwischenprodukte an dem Komplex gebunden bleiben;
- wo zutreffend, entfällt die Hydratisierung des Produktes und das Abstreifen der Hydrathülle vor der nächsten enzymatischen Umwandlung;
- das Prinzip vermindert die Chance, dass Metabolite unangemessene Nebenreaktionen eingehen;
- Multienzymkomplexe können einheitlichen Kontrollmechanismen unterworfen werden.
Beispiele
Der Pyruvatdehydrogenase-Komplex
Dieser Komplex ist die Eintrittspforte des Pyruvats in den Citratzyklus der Mitochondrien. In seiner Gesamtheit wird er durch das eigene Reaktionsprodukt, Acetyl-Coenzym A (AcCoA), reguliert. Er enthält mehrere Einheiten dreier Enzyme
- E1 Pyruvat-Dehydrogenase (EC 1.2.4.1)
- E2 Dihydrolipoyl-Transacetylase (EC 2.3.1.12)
- E3 Dihydrolipoyl-Dehydrogenase (EC 1.8.1.4)
Der „Glykolysekomplex“
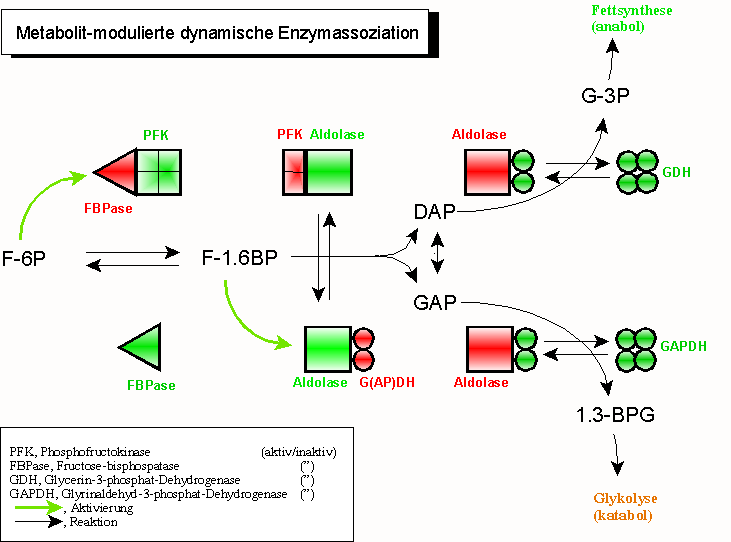
Eine weitere Vervollkommnung dieses Prinzips wurde vor etlichen Jahren durch seinen Pionier, Sidney A. Bernhard (1927–1988; University of Oregon, Eugene) entdeckt, ist jedoch weitgehend unbeachtet geblieben: die „Metabolit-modulierte dynamische Enzymassoziation“ aufeinanderfolgender Mitglieder einer Reaktionskette. Hier werden nach dem Prinzip einer dynamischen Assoziation heterologe Enzympaarungen eingeleitet, die bis zur Umsetzung eines Substrates Bestand haben. Nach diesem Ereignis dissoziiert das „Donorenzym“, während das „Akzeptorenzym“ assoziiert. In einem ständigen Wechsel von Akzeptor- und Donorfunktionen werden damit Metabolite „weitergereicht“ und verändert.
Dieses Prinzip erklärt die Tatsache, dass aufeinanderfolgende Enzyme, wie die Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH) und die Phosphoglyceratkinase (PGK) der Glykolyse nur schwer voneinander zu trennen sind – und wenn, dann unter Aktivitätsverlust.
Schritte im Einzelnen
- Fructose-1,6-bisphosphatase (FBPase, rot) wird durch aktive Phosphofructokinase (PFK, grün) in Schach gehalten. Dadurch wird in den meisten (aber nicht allen) Geweben der gleichzeitige Ablauf gegenläufiger Reaktionen verhindert;
- gleichzeitige Aktivität von PFK und FBPase in einem sogenannten „Substratzyklus“ („futile cycle“) kann jedoch sinnvoll sein (regulatorisches Phänomen, Wärmeerzeugung bei einigen Insekten);
- Fructose-1.6-bisphosphat (F-1.6BP) bindet an Aldolase und bewirkt dadurch
- die Dissoziation des jetzt inaktiven (roten) Vorläuferenzyms PFK; gleichzeitig veranlasst es die Assoziation des noch inaktiven Folgeenzyms (Glycerinaldehyd-3-phosphat-dehydrogenase, GAPDH, bzw. Glycerinphosphat-dehydrogenase, GDH)
- Einschlagen des GDH (NADH,H+-Überschuss) bzw. GAPDH-Weges (NAD+-Überschuss) wird durch den Energiestatus der Zelle bestimmt (NADH,H+-Mangel aktiviert energieerzeugende, katabole Wege, hier die Glykolyse). Die Aktivierung von GDH und GAPDH wird durch Assoziation der inaktiven (roten) Dimer-Formen in die aktiven Tetramere (grün) unterstützt.
Literatur
- D. K. Srivastava, S. A. Bernhard: Metabolite transfer via enzyme-enzyme complexes. In: Science, Band 234, 1986, S. 1081–1086.
- [1]
- M. F. Dunn, G. L. Rossi: Obituary: Recollections of Sidney Bernhard (1927–1988). In: Trends Biochem. Sci., Band 15, 1990, S. 84–85.
- Eckhart Schweizer: Multienzymkomplexe. In: Chemie in unserer Zeit. Band 7, Nr. 1, 1973, S. 25–31, doi:10.1002/ciuz.19730070105.
Einzelnachweise
- ↑ Judit Ovádi: Old pathway — new concept: control of glycolysis by metabolite- modulated dynamic enzyme associations. In: Trends in Biochemical Sciences. Band 13, Nr. 12. Elsevier, 1988, S. 486–490, doi:10.1016/0968-0004(88)90237-x.