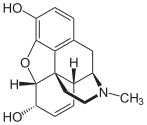
Die Isochinolin-Alkaloide sind Naturstoffe aus der Gruppe der Alkaloide, die sich chemisch vom Isochinolin ableiten. Diese stellen die größte Gruppe unter den Alkaloiden dar.[1]
Aufgrund der unterschiedlichen chemischen Grundstrukturen lassen sich die Isochinolin-Alkaloide noch weiter unterteilen. Die häufigsten Strukturtypen sind die Benzylisochinoline und die Aporphine.[2] Insgesamt werden nach heutigem Kenntnisstand circa 2500 chemische Verbindungen zu den Isochinolin-Alkaloiden gezählt, die hauptsächlich von Pflanzen gebildet werden.[3]
Bekannte Vertreter
Vorkommen in der Natur
Die Isochinolin-Alkaloide werden in erster Linie in den Pflanzenfamilien der Papaveraceae, Berberidaceae, Menispermaceae, Fumariaceae und Ranunculaceae gebildet.
Eine große Rolle spielt dabei der Schlafmohn, der zur Familie der Papavaraceae gehört, da in dem dort enthaltenden Milchsaft, der auch als Opium bezeichnet wird, die Isochinolin-Alkaloide Morphin, Codein, Papaverin, Noscapin und Thebain nachweisbar sind.[3] Neben dem Schlafmohn gibt es noch weitere Mohngewächse, wie beispielsweise das Schöllkraut, in denen Isochinolin-Alkaloide vorkommen. Dieser Milchsaft beinhaltet Berberin, welches aber auch in anderen Pflanzenfamilien, wie den Berberidaceaen, vorkommt.[4] Ein Vertreter der Berberidaceaen mit dem Inhaltsstoff Berberin ist die Gewöhnliche Berberitze.[5]
Zur Untergruppe der Bisbenzylisochinolin-Alkaloide zählt das Tubocurarin; es kommt im behaarten Knorpelbaum vor. Dort wird das Tubocurarin aus der Rinde und den Wurzeln gewonnen.[6]
-
Schlafmohn, enthält Morphin, Codein und Papaverin
-
Schöllkraut, enthält Berberin
-
Gewöhnliche Berberitze, enthält Berberin
Wirkung
Allgemein betrachtet können Isochinolin-Alkaloide unterschiedliche Wirkungen aufweisen. Die Opium-Alkaloide können sedative, psychotrope oder analgetische Eigenschaften haben.[7]
Morphin und Codein werden dabei als Analgetika eingesetzt.[8]
Papaverin hingegen hat eine krampflösende Wirkung, falls diese von der glatten Muskulatur stammt, wie sie beispielsweise beim Menschen im Magen-Darm-Trakt oder in Blutgefäßen vorkommt. Deswegen wird es als Spasmolytikum eingesetzt.[9]
Tubocurarin beeinträchtigt die Reizweiterleitung in Nervensystemen, sodass es im betroffenen Organismus zu Lähmungserscheinungen kommen kann.[10]
Siehe auch
Weblinks
Einzelnachweise
- ↑ Gerhard Habermahl, Peter E. Hammann, Hans C. Krebs, Waldemar Ternes: Naturstoffe. Springer-Verlag, Berlin/Heidelberg 2008, ISBN 978-3-540-73733-9, doi:10.1007/978-3-540-73733-9, S. 176–187.
- ↑ Bettina Ruff: Chemische und biochemische Methoden zur stereoselektiven Synthese von komplexen Naturstoffen. Verlag Logos, Berlin 2012, ISBN 978-3-8325-3121-8, S. 8. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ a b Jennifer M. Finefield, David H. Sherman, Martin Kreitman, Robert M. Williams: Enantiomere Naturstoffe: Vorkommen und Biogenese. In: Angewandte Chemie. 2012, 124 (20), S. 4886–4920, doi:10.1002/ange.201107204, S. 4905–4915.
- ↑ A. Husemann, T. Husemann: Die Pflanzenstoffe in chemischer, physiologischer, pharmakologischer und toxikologischer Hinsicht. Berlin 1871, S. 245–253. (Digitalisat Bayerische Staatsbibliothek).
- ↑ Eintrag zu Berberin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Dezember 2017.
- ↑ Rudolf Hänsel, Joseph Hölzl: Lehrbuch der pharmazeutischen Biologie. Springer-Verlag, Berlin / Heidelberg / New York 2012, 1996, ISBN 3-642-64628-X, doi:10.1007/978-3-642-60958-9, S. 302.
- ↑ Rainer Nowack: Notfallhandbuch Giftpflanzen: Ein Bestimmungsbuch für Ärzte und Apotheker. Springer-Verlag, Berlin/Heidelberg 1998, doi:10.1007/978-3-642-58885-3, S. 258.
- ↑ Jens Frackenpohl: Morphin und Opioid-Analgetika. In: Chemie in unserer Zeit. 2000, 34, Nr. 2, doi:10.1002/1521-3781(200004)34:2<99::AID-CIUZ99>3.0.CO;2-X, S. 99–112.
- ↑ Franz v. Bruchhausen, Gerd Dannhardt, Siegfried Ebel, August-Wilhelm Frahm, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis. 5. Auflage. Springer-Verlag, Berlin / Heidelberg 1994, doi:10.1007/978-3-642-57880-9, S. 16.
- ↑ Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie. 16. Auflage. Georg-Thieme Verlag, Stuttgart / New York 2006, ISBN 3-13-368516-3, S. 255–258.