| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Struktur ohne Darstellung der stereochemischen Konfiguration | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Caran | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C10H18 | ||||||||||||
| Kurzbeschreibung |
farblose, angenehm riechende Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 138,25 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
0,841 g·cm−3[1] | ||||||||||||
| Siedepunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
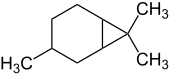
Caran ist ein bicyclischer, verbrückter Kohlenwasserstoff, der das Grundgerüst für eine Gruppe von Terpenen bildet. Mit der Summenformel C10H18 ist es ein Monoterpen, also ein Konstitutionsisomer von Bornan und Pinan.
Struktur
Caran und die von ihm abgeleiteten Terpene können auch als Derivate des Kohlenwasserstoffs Bicyclo[4.1.0]heptan aufgefasst werden. Diese Stammverbindung besteht aus einem Sechsring (Cyclohexanring) und einem Dreiring (Cyclopropanring), welche cis-verknüpft (anelliert) sind. Die Kohlenstoffatome des Sechsrings liegen nicht in einer Ebene. Im Caran finden sich noch zwei geminale Methylgruppen am Kohlenstoffatom Nr. 7 und eine Methylgruppe an C-3. Projiziert man die Kohlenstoffatome des Sechsrings in eine Ebene, so kann das C-3-Methyl (= C-10) auf derselben Seite wie C-7 (des Dreirings) liegen, oder auf der entgegengesetzten. Daher sind zwei Isomere (Diastereomere) des bicyclischen Kohlenwasserstoffs möglich, welche als cis-Caran bzw. trans-Caran bezeichnet wurden. Beide Isomere sind chiral.
| Isomere von Caran | ||
| Name | cis-Caran | trans-Caran |
| Andere Namen |
|
|
| Strukturformel |  |

|
| CAS-Nummer | 18968-24-6 2778-68-9 (–)-cis |
18968-23-5 (+)-trans |
| 554-59-6 (unspez.) | ||
| PubChem | 12302437 | 12302439 |
| 79043 (unspez.) | ||
| Brechungsindex | 1,4550 bei 20 °C[3][4] | 1,4565 bei 20 °C[4] |
| Optische Aktivität [α]D20 | −37,7°[4] | +63,5°[4] |
Vorkommen und Herstellung
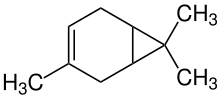
Die Kohlenwasserstoffe scheinen in der Natur nicht vorzukommen, wohl aber der ungesättigte Kohlenwasserstoff 3-Caren als Bestandteil von Terpentinölen, sowie einige Alkohole und Ketone.
Eine Synthese von cis-Caran geht vom 3-Caren aus, welches nach Hydroborierung und Oxidation den Alkohol cis-Caran-trans-4-ol lieferte. Dieser wurde deoxygeniert, indem sein Tosylat mit Lithiumaluminiumhydrid reduziert wurde.[4]
trans-Caran wurde aus Caran-2-on durch Wolff-Kishner-Reduktion erhalten. Das Keton ist jedoch kein Naturstoff, sondern wurde synthetisch hergestellt.[4]
Die einfachste Methode zur Herstellung dieser bicyclischen Kohlenwasserstoffe sollte die Hydrierung von 3-Caren sein. Sie ist jedoch nicht selektiv. Bei der heterogenen katalytischen Hydrierung wurde eine vorhergehende Isomerisierung (Äquilibrierung) zu 2-Caren beobachtet. Am Ende entsteht cis-Caran neben 1,1,4-Trimethylcycloheptan, d. h. zum Teil wird die C-1/C-6 Bindung hydrogenolytisch gespalten.[5] So soll bei der heterogenen katalytischen Hydrierung mit Platinmohr ein Gemisch von cis-Caran (65 %), trans-Caran (32,5 %) und 1,1,4-Trimethylcycloheptan (2,5 %) gebildet werden. Durch fraktionierende Destillation des Gemisches kann reines cis- und trans-Caran gewonnen werden.[6]
Literatur
- D. Whittaker: The Monoterpenes in: A. A. Newman (Hrsg.): Chemistry of Terpenes and Terpenoids. S. 35, Academic Press, London 1972, ISBN 0-12-517950-2
Einzelnachweise
- ↑ a b c Eintrag zu Caran. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Oktober 2012.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ John Lionel Simonsen: The Terpenes Volume II The Dicyclic Terpenes, Sesquiterpenes and their ... University Press, 1947, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f W. Cocker, P. V. R. Shannon and P. A. Staniland: The chemistry of terpenes. Part II. The physical properties of some cis–trans substituted cyclohexanes. J. Chem. Soc. C, 1966, 946–949, doi:10.1039/J39660000946.
- ↑ Wesley Cocker, P. V. R. Shannon, P. A. Staniland: The chemistry of terpenes. Part I. Hydrogenation of the pinenes and the carenes, J. Chem. Soc. C, 1966, 41–47, doi:10.1039/J39660000041.
- ↑ I. I. Bardychev, E. F. Buinova, A. L. Pertsovskii: Synthesis and study of the properties of cis- and trans-caranes, Vesti Acad. Navuk Belarus. S.S.R. Ser. Khim. Navuk, 1970, 99–101. Zitiert nach Chemical Abstracts, Vol 74 (1971), Referat Nr. 112223j (74:112223j).








