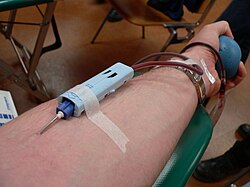
Bluttransfusion bezeichnet die intravenöse Gabe (Übertragung bzw. Infusion) von Erythrozytenkonzentraten (Erythrozyten = rote Blutzellen) oder (heute sehr selten) von (Voll-)Blut. Stammen das Blut bzw. die Blutbestandteile von einem fremden Blutspender, handelt es sich um Fremdblut und eine Fremdblutspende (Allotransfusion). Sind Blutspender und Blutempfänger dieselbe Person, spricht man von einer Eigenblutspende (Autotransfusion). Sie ist eine Anwendung von zellulären Blutprodukten, ähnlich der Gabe von Thrombozyten- und Granulozytenkonzentraten.
Voraussetzung für eine erfolgreiche Transfusion ist, dass das verabreichte Blut bzw. die Blutbestandteile Blutgruppen-kompatibel sind. Jede Bluttransfusion erfordert die Einwilligung des Patienten nach entsprechender Aufklärung[1] durch einen Arzt, wovon nur in begründeten Notsituationen abgewichen werden kann.
Die erste Bluttransfusion von Tier zu Tier gelang 1666, die erste von Tier zu Mensch 1667; die erste Transfusion von Mensch zu Mensch erfolgte 1824 in London.
Übertragene Blutkomponenten


Vollbluttransfusionen werden heute nur noch selten durchgeführt. In der Regel wird heute das Blut in seine Komponenten aufgetrennt und komponentenweise transfundiert.
Das hat zwei Vorteile: Zum einen erhält der Patient nur die Blutbestandteile, die ihm fehlen, beispielsweise nur Erythrozyten (rote Blutzellen) bei Anämie, nur Plasma bei Mangel von Plasmaproteinen. Zum anderen lassen sich die Blutkomponenten in getrennter Form wesentlich länger aufbewahren. Vollblut muss bei mindestens 4 °C aufbewahrt werden, da ansonsten die Erythrozyten und vor allem die Blutplättchen (Thrombozyten) Schaden erleiden. Bei dieser Temperatur verlieren viele Plasmaproteine (insbesondere die Gerinnungsfaktoren) innerhalb von Tagen ihre Wirksamkeit. Trennt man dagegen das Plasma ab, so kann man es einfrieren und monatelang ohne Funktionsverlust lagern.
Transfundiert werden:
- Erythrozyten-Konzentrate (EK): bei Blutarmut (Anämie)
- Granulozyten-Konzentrate: bei Mangel an Granulozyten (Granulozytopenie) und schweren Infektionen
- Thrombozyten-Konzentrate (TK): bei Mangel an Thrombozyten (Thrombozytopenie) und Blutungsneigung
- Plasma (Gefrierfrischplasma, FFP = fresh frozen plasma): bei Mangel an Plasmaproteinen (z. B. nach großen Blutverlusten) oder bei Blutungsneigung
- Blutstammzell-Präparate i. d. R. im Rahmen einer Stammzelltransplantation
- Gerinnungsfaktor-Konzentrate: bei Mangel an Gerinnungsfaktoren
- Immunglobuline bei Antikörper-Mangel mit Infektneigung
- Humanalbumin bei symptomatischem Albuminmangel (Hypalbuminämie)
Indikation zur Transfusion von Blutbestandteilen
Blutkomponenten werden eingesetzt bei
- akutem Blutverlust und hämorrhagischem Schock (z. B. Unfall, Operation) bis zu Massivtransfusion
- chronische Blutkrankheiten im Sinne einer Blutbildungsstörung (Anämien, Hämoblastosen, Agranulozytose)
Ob eine Therapie angezeigt ist, wird am Hämoglobin (Hb) gemessen. Die Hb-Normwerte für Männer sind 8,6–11,2 mmol/l (14–18 g/dl), für Frauen 7,4–10 mmol/l (12–16 g/dl). (Zur Besonderheit der Bestimmung der Hb-Werte in mmol/l siehe Hämoglobin.) Es gibt seltene Formen von angeborenen Blutbildungsstörungen, bei denen die Patienten seit Geburt einen sehr niedrigen Hb-Wert haben, damit aber gut im Alltag zurechtkommen. Andererseits können Menschen mit ausgeprägter Herzinsuffizienz (Herzschwäche) und anderen kardialen Vorerkrankungen wie der koronaren Herzkrankheit schon Hb-Werten unter 9,0 g/dl Symptome im Sinne von Luftnot, Kreislaufschwäche etc. bekommen. Wann eine Transfusion zu erfolgen hat, muss also individuell entschieden werden. Grundsätzlich gilt, dass eine langsam (z. B. über Monate) entstandene Anämie vom Patienten besser toleriert wird als eine, die durch eine massive Blutung innerhalb von Stunden entsteht.
Die von der EU-Kommission beauftragte SANGUIS-Studie (1994) stellte fest, dass die Entscheidungen, wann eine Bluttransfusion zu erfolgen hat und wie viel transfundiert werden soll, zwischen einzelnen Krankenhäusern in Europa oft stark unterschiedlich getroffen werden. Die verordnete Menge unterschied sich, je nach Krankenhaus und Region, teilweise um den Faktor 10. Diese Ergebnisse werden als Anzeichen dafür gewertet, dass generell zu viel Blut transfundiert wird.[2]
Plasma- oder Thrombozytentransfusionen können auch zur Blutungsprävention bei Patienten mit Blutgerinnungsstörungen vor verschiedenen chirurgischen Eingriffen verwendet werden. Dazu hat Cochrane Haematology einige Übersichtsarbeiten veröffentlicht.[3][4][5]
Außerdem können Thromboztentransfusionen auch bei Patienten mit hämatologischen Erkrankungen während einer Chemotherapie oder einer Stammzelltransplantation notwendig sein.[6][7]
Kompatibilität (verträgliche Blutgruppen)
| Empfänger | Spender |
|---|---|
| 0 | 0 |
| A | A und 0 |
| B | B und 0 |
| AB | AB, A, B und 0 |
| Empfänger | Spender |
|---|---|
| 0 | AB, A, B und 0 |
| A | A und AB |
| B | B und AB |
| AB | AB |
Bei der Transfusion von zellulären Blutprodukten und Blutplasma müssen die verschiedenen Blutgruppenmerkmale beachtet werden. Es darf nur blutgruppenverträgliches (sog. kompatibles) Blut übertragen werden, sonst kommt es zu einer lebensbedrohlichen immunologischen Reaktion auf das fremde Blut. Besonders wichtig sind in diesem Zusammenhang das AB0-Blutgruppensystem und der Rhesusfaktor. Während in den meisten anderen Blutgruppensystemen Antikörper gegen fremde Merkmale erst nach einer Transfusion gebildet werden und somit erst frühestens einige Tage später, bei einer erneuten Transfusion, stören würden, sind im AB0-System solche Antikörper grundsätzlich gegen alle AB0-Merkmale vorhanden, die der Empfänger selber nicht hat.
Erhält eine Person mit Blutgruppe „A“ eine Spende vom Typ „B“, kann eine hämolytische Reaktion ausgelöst werden, die viele rote Blutkörperchen zerstört. Wird eine Rh-negative Person dem Blut eines Rh-positiven Spenders ausgesetzt, kann sie Rhesus-Antikörper entwickeln, die bewirken, dass Rh-positive rote Blutkörperchen zerstört werden. Aufgrund der hierbei aus den Zellen freigesetzten Substanzen ist eine Zerstörung von Erythrozyten nachteilig und kann tödlich enden.
Die Blutgruppen-Kompatibilität bei Transfusion von Plasma ist für AB0 gerade umgekehrt zu der Transfusion von Erythrozyten (siehe nebenstehende Tabellen), das heißt, genau dann wenn Person A an Person B rotes Blut spenden kann, kann Person B auch an Person A Plasma spenden.
Nebenwirkungen und Risiken
- Siehe auch: Hämovigilanz
Wie bei jedem anderen Arzneimittel kann es auch bei Blutprodukten zu unerwünschten Reaktionen und Nebenwirkungen kommen.

Immunologische Nebenwirkungen
Eine schwerwiegende Ursache für einen Transfusionszwischenfall ist die Verwechslung von Blutkonserven. Durch Transfusion von AB0-inkompatiblen Blut kann es zur akuten hämolytischen Transfusionsreaktion (HTR) kommen. Daher ist unmittelbar vor der Transfusion der Bedside-Test am Patientenbett zur Testung der (AB0-)Blutgruppe des Empfängers auf einer Testkarte vorgeschrieben. Man unterscheidet die akute hämolytische Transfusionsreaktion (AHTR) von der Verzögerten (VHTR).
Nichthämatolytische Transfusionsreaktionen (NHTR) umfassen allergische Reaktionen bis zur Anaphylaxie, das Auftreten einer posttransfusionellen Purpura sowie das transfusionsassoziierte akute Lungeninsuffizienzsyndrom (Transfusion related acute lung injury, TRALI). Dieses stellt eine der gefährlichsten Transfusionsreaktionen dar (Häufigkeit 1:2500 bis 1:100.000). Durch eine Schädigung der Lungengefäße (Trauma, Operation, Entzündung, Vergiftung) mit massiver Flüssigkeitsüberladung der Lunge, die zum Lungenversagen führt. Die Behandlung erfolgt intensivmedizinisch, meist ist eine Beatmung notwendig. Die Sterblichkeit beträgt bis zu 15 %.
Vermehrungsfähige weiße Blutkörperchen können bei der Übertragung an immungeschwächte Patienten auch die Graft-versus-Host-Reaktion (Transplantat-gegen-Wirt-Reaktion) hervorrufen, bei der die fremden Leukozyten den Empfängerorganismus angreifen. Seit 2001 werden deshalb in Deutschland ausschließlich solche Vollblutpräparate, Erythrozytenkonzentrate und Thrombozytenkonzentrate in Verkehr gebracht, deren Leukozytengehalt weniger als 1.000.000 pro Einheit (Blutkonserve) beträgt (leukozytendepletierte Präparate). Das Risiko für eine GvH-Reaktion kann auch durch die Bestrahlung von Blutprodukten reduziert werden.
Infektionen

Mit einer Blutkonserve können Bakterien (z. B. Treponema pallidum) und Viren (HIV, Hepatitis-C-Virus (HCV), Hepatitis-B-Virus (HBV)) sowie selten Protozoen und Prionen übertragen werden.
Heutzutage ist dank einer sorgfältigen Spenderauswahl und der Einführung von molekularbiologischen Testmethoden die Gefahr der Übertragung von HBV, HCV und HIV äußerst gering (jeweils unter 1:1 Million). Bis zur Entwicklung dieser Testverfahren Mitte der 1980er Jahre wurden in Deutschland über 1.500 Personen durch Bluttransfusionen mit HIV infiziert, besonders Hämophile waren von Infektionen mit HIV und HCV betroffen. Seit 1985 hat die Zahl der transfusionsbedingten HIV-Übertragungen dank Antikörpertests und der hochspezifischen Polymerase-Kettenreaktion (PCR) drastisch abgenommen. Bei Hepatitis C wurde 1991 eine Antikörpertestung eingeführt. Davor war das HCV die hauptsächliche Ursache der nicht seltenen Posttransfusionshepatitis.[8] Die häufigsten Virusübertragungen betrifft das Cytomegalie- (1:10 bis 1:30) und Epstein-Barr-Virus (1:200), was bei immunsupprimierten Patienten relevant ist. Ab Oktober 2019 wird verbindlich auf Hepatitis E getestet.[9][10]
Bakterielle Infektionen betreffen fast ausschließlich Thrombozytenpräparate, die bei Raumtemperatur gelagert werden müssen.
Um die Infektionsgefahr zu vermindern, werden spezielle Techniken und industrielle Prozesse zur Virusinaktivierung angewandt.[11][12]
Weitere Nebenwirkungen
Weitere mögliche Nebenwirkungen sind eine Eisenüberladung (Hämosiderose) bei langfristiger Transfusionstherapie sowie Auswirkungen des enthaltenen Citrats, Unterkühlung (Hypothermie) und Volumenüberlastung des Körpers bei großen Transfusionsvolumen.
Unklar war bislang, ob Blutspenden von Patienten mit einer (subklinischen) Krebserkrankung für den Empfänger ein erhöhtes Risiko bergen, im weiteren Verlauf selbst an Krebs zu erkranken. Eine 2007 in der Fachzeitschrift The Lancet publizierte Studie konnte nachweisen, dass dem nicht so ist: Auch wenn der Blutspender zu einem späteren Zeitpunkt an Krebs erkrankt, bringt eine Bluttransfusion für den Empfänger kein erhöhtes Krebsrisiko mit sich.[13]
In einer epidemiologische Studie in der Ausgabe des International Journal of Cancer vom 15. September 2009 wurde hingegen nachgewiesen, dass verabreichte Bluttransfusionen die Wahrscheinlichkeit erhöhen, an Lymphdrüsenkrebs zu erkranken.[14]
Blutspender
Entscheidend für den Erfolg einer Bluttransfusion ist die sorgfältige Auswahl von Blutspendern. In der Richtlinie Hämotherapie[15] werden folgende Kriterien genannt:
Untersuchung des Blutspenders
- Alter bei Erstspende 18 – 60 Jahre, bei Wiederholungsspende bis 68 Jahre
- Körpergewicht mindestens 50 kg
- Hämoglobin mindestens 7,75 mmol/l Blut bei weiblichen und 8,35 bei männlichen Spendern
- Blutdruck systolisch: 100 – 180 mm Hg, diastolisch: unter 100 mm Hg, Pulsfrequenz 50 – 110/min
- kein Fieber
- Haut an der Punktionsstelle frei von Läsionen (keine Verletzung oder Entzündung)
Spenderausschluss bei folgenden Erkrankungen
- schwere Herz- und Gefäßkrankheiten
- schwere Erkrankungen des Zentralnervensystems
- klinisch relevante Blutgerinnungsstörungen
- wiederholte Ohnmachtsanfällen oder Krämpfen
- schwere aktive oder chronische Krankheiten des gastrointestinalen, urogenitalen, hämatologischen, immunologischen, metabolischen, renalen oder respiratorischen Systems
- bösartige, invasive Tumoren
- Insulin-pflichtiger Diabetes mellitus
Spenderausschluss bei folgenden Infektionserkrankungen
- HIV-1 oder HIV-2, AIDS
- Hepatitis B oder C, ansteckende Leberentzündung
- HTLV Typ 1 oder Typ 2 (Virus-Infektion)
- Protozoonosen: Babesiose, Trypanosomiasis (z. B. Chagas-Krankheit), Leishmaniose: einzellige Krankheitserreger
- Syphilis
- Malaria
- Tuberkulose
- andere chronisch persistierende bakterielle Infektionen
Spenderausschluss bei einem Risiko der Übertragung spongiformer Enzephalopathien (TSE)
- nach Behandlung mit menschlichen Hypophysen-Extrakten
- nach Erhalt von Dura mater- bzw. Korneatransplantaten (menschliche Hirnhaut oder Hornhaut des Auges)
- bei nachgewiesener oder einem Verdacht auf TSE (Creutzfeldt-Jakob-Krankheit oder andere TSE)
- Creutzfeldt-Jakob-Krankheit oder eine andere TSE bei Blutsverwandten
- nach einem Aufenthalt in Großbritannien mehr als 6 Monaten in den Jahren 1980–1996
- nach Operation oder Transfusion in Großbritannien nach dem 1. Januar 1980
Spenderausschluss bei riskanter Lebensführung
- Drogenabhängigkeit
- sexuelles Risikoverhalten
Zeitweise Rückstellung von Spendern
Der verantwortliche Arzt der Blutspendeeinrichtung kann aus verschiedenen Gründen einen zeitlich begrenzten Spendeausschluss bestimmen. Gründe können zum Beispiel der Aufenthalt in einem Malariagebiet oder unklare nicht abgeklärte Symptome einer Erkrankung darstellen.
Wie bei allen medizinischen Eingriffen darf eine Blutentnahme bei der Blutspende nur nach eingehender Aufklärung über mögliche Nebenwirkungen und Komplikationen und Einwilligung erfolgen.
Alternativen
Autologe Hämotherapie
Unter den autologen Behandlungsverfahren versteht man die Gewinnung und den Einsatz patienteneigenen Blutes. Dies kann durch eine Eigenblutspende oder akute normovoläme Hämodilution (Blutgewinnung und Ersatz durch Infusion mit anschließender Re-Transfusion) vor der Operation sowie die maschinelle Autotransfusion (MAT, Eigenblutrückgewinnung aus Operationsblut) und den Einsatz blutsparender Operationstechniken geschehen. Die Kombination verschiedener Verfahren erhöht die Effektivität.
Blutersatzstoffe
Künstliche Blutersatzstoffe auf Perfluorcarbonbasis und Hämoglobinpräparate werden intensiv erforscht, aber noch nicht routinemäßig eingesetzt.
Plasmaersatzstoffe und Plasmaexpander
Synthetische Plasmaersatzstoffe bieten unter gegebenen Umständen eine Alternative zu Bluttransfusionen: Blutverlust (Hypovolämie) kann durch blutfreie Infusionen ausgeglichen werden. Geeignet sind künstlich hergestellte kolloidale Lösungen auf Basis von Dextran, Hydroxyethylstärke (HES) oder Gelatine, die zum „Auffüllen“ der Flüssigkeitsmenge und zur Aufrechterhaltung des Blutdrucks dienen.[16] Diese kolloidalen Volumenersatzmittel können eine akute Niereninsuffizienz begünstigen.
Vorteile sind ein geringeres Risiko von Unverträglichkeiten oder Infektionen, preiswertere Herstellung und Lagerung sowie die Akzeptanz bei Patienten, die Bluttransfusionen aus weltanschaulichen bzw. ethischen[17] oder moralischen bzw. religiösen Gründen ablehnen (z. B. viele Zeugen Jehovas).[18] Nachteile sind mögliche allergische Reaktionen bei gelatinebasierten Plasmaersatzstoffen, eine Beeinträchtigung der Blutgerinnung, und dass keine Sauerstoffträger (Hämoglobin) enthalten sind.
Rechtliche Grundlagen
Das Transfusionswesen in Deutschland wird auf rechtlicher Ebene durch das Transfusionsgesetz geregelt. Die konkrete Umsetzung der Vorschriften geht aus den Hämotherapie-Richtlinien und Leitlinien der Bundesärztekammer hervor, die teilweise sehr detailliert festlegen, wie die einzelnen Handlungsschritte von der Auswahl des Spenders bis zur Überwachung des Empfängers zu erfolgen haben.
Einrichtungen der Krankenversorgung im stationären und ambulanten Bereich, die Blutprodukte anwenden (z. B. Krankenhäuser, Arztpraxen usw.), sind durch § 15 Transfusionsgesetz zur Einrichtung eines Systems der Qualitätssicherung verpflichtet. Qualitätssicherung umfasst die Gesamtheit der personellen, organisatorischen, technischen und normativen Maßnahmen, die geeignet sind, die Qualität der Versorgung der Patienten zu sichern, zu verbessern und gemäß dem medizinisch-wissenschaftlichen Kenntnisstand weiterzuentwickeln (§§ 135a, 136 und 137 Fünftes Buch Sozialgesetzbuch (SGB V)).
Im Rahmen des Qualitätssicherungssystems sind die Qualifikationen und die Aufgaben der verantwortlichen Personen festzulegen.
Gesetzlich vorgeschrieben für alle Einrichtungen, die Blutprodukte anwenden, ist die Bestellung eines
- Transfusionsverantwortlichen (für die gesamte Einrichtung),
- Transfusionsbeauftragten (für jede Behandlungseinheit / Abteilung)
- Qualitätsbeauftragten (für die gesamte Einrichtung).
Einrichtungen mit Akutversorgung müssen darüber hinaus eine Kommission für transfusionsmedizinische Angelegenheiten (Transfusionskommission) bilden.
Rechtliche Voraussetzungen
Allgemein stellt die Gabe von Blut- und Blutprodukten (also von zellulären und nichtzellulären Blutprodukten) die Anwendung eines Arzneimittels dar. Daher sind diese Blutzubereitungen Arzneimittel im Sinne von § 4 Abs. 2 des Arzneimittelgesetzes (AMG).[19] Deshalb zählt man auch die Sera (nichtzelluläre Blutbestandteile) die aus dem menschlichen Blut und die zellulären Blutbestandteile die zur Herstellung von Wirkstoffen oder Präparaten bestimmt sind, im Sinne der § 2 (1) und § 4 (2 und 3) des AMG mit § 2 Nr. 3 Transfusionsgesetz (TFG)[20] zu den Arzneimitteln. Sie unterliegen damit den Vorschriften des Arzneimittelrechtes.
Geschichte
Die Anfänge
Schon sehr früh galt das Blut als etwas sehr Kostbares; so wurde schon im Altertum Blut übertragen (alte Bezeichnungen: Haemometachysis, Transfusio sanguinis[21]). Jedoch wurde dies als Trank (beispielsweise Tierblut als Heilmittel bei Epilepsie) verabreicht. Die Verabreichung von tierischem oder menschlichem Blut (als Trank oder Einreibung) gründete sich vor allem auf der Vorstellung, damit Kraft, Vitalität, Gesundheit, Charakter übertragen zu können oder eine Lebensverlängerung durch Verjüngung zu erreichen.[22] Im Juli 1492 soll der im Sterben liegende Papst Innozenz VIII. – auf ärztliche Empfehlung – das Blut von drei zehnjährigen Jungen getrunken haben. Man erhoffte sich dadurch angeblich die Verjüngung des betagten Kirchenfürsten. Die drei Kinder überlebten das Experiment angeblich nicht und auch der Papst blieb so krank wie zuvor.[23] Da der einzige Bericht dieser Blutübertragung der Feder des radikalen Antipapisten Stefano Infessura entstammt, ist der Wahrheitsgehalt sehr umstritten. Doch auch der Florentiner Arzt Marsilio Ficino hatte schon 1489 als gerokomisches „Verjüngungmittel“ empfohlen, dass Greise nach Art der Blutegel aus der frisch eröffneten linken Armvene eine oder zwei Unzen saugen sollen.[24]


Erst als der englische Gelehrte William Harvey im 17. Jahrhundert den Blutkreislauf entdeckt hatte und 1656 die intravenöse Injektion erfunden worden war, konnte die Grundlage für Infusionen und Transfusionen geschaffen werden.
Der toskanische Arzt Francesco Folli (1624–1685) berichtete 1680[25] über eine 1654 erstmals von ihm vorgenommene Bluttransfusion.[26] Der Brite Richard Lower übertrug im Februar[27] 1666 an zwei Hunden als Erster erfolgreich Blut von Tier zu Tier.[28] Ein Jahr danach übertrugen zum ersten Mal die Franzosen Jean-Baptiste Denis und Pièrre Emmerez Tierblut (vom Lamm) auf Menschen. Die immunologischen Unverträglichkeiten solcher Transfusionen wurden als „Schaf-Melancholie“ verharmlost.[29] Aufgrund vieler Todesfälle war die Bluttransfusion jedoch umstritten.[30] Der Chirurg Lorenz Heister führt in seinem Lehrbuch von 1718 bereits ein Kapitel mit dem Titel Chirurgia transfusoria.[31] Die erste erfolgreiche Transfusion mittels ungerinnbar gemachtem Blut bei Tieren beschrieben 1821[32] Jean Louis Prévost und Jean-Baptiste Dumas.[33]
Als „Vater der modernen Transfusion“ im Sinne der Bluttransfusion von Mensch zu Mensch bezeichnete man den englischen Geburtshelfer James Blundell. Dieser übertrug 1824[34] erfolgreich menschliches Blut auf eine ausgeblutete Wöchnerin. Die erste dokumentierte erfolgreiche Bluttransfusion in Deutschland nahm 1828 der Heilbronner Arzt Georg Klett vor. Obwohl nur jede zweite Transfusion erfolgreich verlief, setzte sich die Bluttransfusion als Behandlungsmethode bei massivem Blutverlust durch. Der französische Chirurg Alphonse Guérin (1817–1895)[35] entwickelte ein Verfahren der unmittelbaren Bluttransfusion.
Im Deutsch-Französischen Krieg 1870/71 wurden mehrere Bluttransfusionen durchgeführt.[36]
Leonard Landois war ein Pionier bei der Untersuchung von Bluttransfusionen. So widmete er sich der Erforschung der physiologischen Folgen der heterologen Transfusion und beschrieb die Phänomene der Agglutination. Im Jahre 1875[37] zeigte er, dass dann, wenn Erythrozyten einer Tierart mit dem Blutserum einer anderen Tierart gemischt werden, sich die roten Blutkörperchen typischerweise verklumpen und manchmal platzen (Hämolyse).[38]
Das Blut wurde im 19. Jahrhundert intensiv durch Naturwissenschaftler erforscht. Den Grundstein für die moderne Transfusionsmedizin legte der Wiener Arzt Karl Landsteiner, als er zusammen mit seinen Mitarbeitern 1901 und 1902 die Blutgruppen A, B, 0 und AB entdeckte. Mit der Zeit ging man von der direkten Transfusion zwischen zwei Menschen auf die indirekte Transfusion mittels einer Blutkonserve über. Dies wurde 1914 durch den Zusatz von Natriumcitrat möglich, das die Blutgerinnung außerhalb des Körpers verhindert (Zuvor wurde versucht, das Blut vor der Injektion über Spritzen durch längeres Umrühren zu „defibrinieren“ und damit ungerinnbar zu machen[39]). Eine Zuckerzugabe ermöglichte es, Blut zu lagern (Albert Hustin, Richard Lewisohn).
Der erste Bluttransfusionsdienst
Der erste Bluttransfusionsdienst und somit der erste öffentliche Blutspendedienst[40] wurde in London im Oktober 1921 gegründet – schon damals mit Hilfe freiwilliger und unbezahlter Spender. Auch damals war das Rote Kreuz schon federführend beteiligt. Die Chamberville Division des Britischen Roten Kreuzes in London erhielt einen dringenden Anruf vom King’s College Hospital. Das Krankenhaus fragte an, ob jemand bereit wäre, Blut für einen Schwerkranken zu spenden. Percy Oliver, freiwilliger Sekretär der Division, und sechs weitere Rotkreuz-Mitarbeiter erklärten sich spontan bereit – einer von ihnen hatte die richtige Blutgruppe.
Um auf solche Fälle künftig besser vorbereitet zu sein, gründete Oliver den ersten Bluttransfusionsdienst – und stellte schon damals die Bedingung: Die Blutspende musste freiwillig sein und durfte nicht bezahlt werden.
Bei der Direktübertragung vom Blutspender zum -empfänger, etwa mit der „Beckschen Mühle“, wurde zunächst eine kleine Menge übertragen, dann etwa zehn Minuten gewartet, ob Schocksymptome auftraten (Übelkeit, Ohnmacht, Nierenschmerzen), und dann die Transfusion fortgesetzt.[41]
Die Entdeckung weiterer Blutgruppensysteme, aber vor allem des Rhesus-Merkmals um 1940 durch amerikanische Forscher brachte zusätzliche Fortschritte im Hinblick auf die Sicherheit der Bluttransfusion und führte zur Entwicklung eines neuen wissenschaftlichen Gebiets, der Immunhämatologie. Mit der Aufteilung des Blutes in seine Bestandteile ermöglichte ab 1941 das von Cohn entdeckte und bis heute vereinfachte Verfahren die gezielte und bestmögliche Ausnutzung einer Blutspende für die darauf angewiesenen Patienten. Die Glasflasche wurde vom Mehrfach-Kunststoffbeutel abgelöst und die „Hämotherapie nach Maß“ mit Blutkomponenten etablierte sich weltweit.[23]
Zeitleiste
| 1628 | William Harvey entdeckt den Blutkreislauf. |
| Februar 1666 | Der englische Arzt Richard Lower führt erstmals eine erfolgreiche Transfusion bei Hunden durch. |
| 15. Juni 1667 | Jean-Baptiste Denis vollführt die erste aufgezeichnete erfolgreiche Blutübertragung von Tierblut (einem Lamm) zum Menschen (ein 15-jähriger Junge). Im selben Jahr berichtet auch Richard Lower eine erfolgreiche Blut-Transfusion von Lamm zu Mensch. |
| 1668 | Die erste Bluttransfusion auf deutschem Boden führte Matthäus Gottfried Purmann in Frankfurt (Oder) durch. Ein Herr Welslein wurde durch übertragenes Lämmerblut vom Aussatz (Lepra) geheilt – 200 Jahre bevor der Wiener Pathologe Karl Landsteiner geboren wurde, der das AB0-Blutgruppensystem entdeckte. |
| 1. September 1818 | Die erste Bluttransfusion von Mensch zu Mensch fand im Londoner St. Guy’s Hospital statt. Der Patient von James Blundell erhielt etwa einen halben Liter Blut verschiedener Spender. Er überlebte den Eingriff nicht. |
| 1873 | Der Arzt Franz Gesellius schlägt die Transfusion von Lammblut vor,[42] die noch im selben Jahr von Oscar Hasse in mehreren Fällen ausgeführt wird.[43] In der Folge werden zahlreiche Übertragungen von Lammblut auf den Menschen durchgeführt und in Fachpublikationen veröffentlicht.[44] Auch der Deutsche Chirurgenkongress beschäftigte sich 1874 mit der Frage von Lammblutinfusionen auf den Menschen.[45] |
| 1875 | Leonard Landois lehnt nach eingehenden physiologischen Studien und der Auswertung von Fallbeispielen die Lammbluttransfusion ab und warnt vor dem tödlichen Potential dieser Operation.[46] Landois beschreibt dabei den Vorgang der Agglutination bzw. Hämolyse, ohne deren Bedeutung zu erkennen.[47] |
| 1884 | Salzlösung wird aufgrund der gehäuften Abwehrreaktionen gegen Milch als Blutersatz verwendet. |
| 1901 | Der Wiener Pathologe Karl Landsteiner entdeckt das AB0-Blutgruppensystem. Er erhielt im Jahre 1930 den Nobelpreis für diese Entdeckung. |
| 1902 | Alfred von Decastello und Adriano Sturli entdecken die vierte Bluthauptgruppe AB.[48] |
| 1907 | Ludvig Hektoen schlägt den Kreuztest als Verträglichkeitstest vor, um unverträgliche Kombinationen auszuschließen. In der Folge erkennt Reuben Ottenberg die mendelschen Vererbungsmerkmale, und dass die Gruppe 0 als Universalspender dienen kann. |
| 1914 | Luis Agote vom Hospital Rawson de Buenos Aires (Argentinien) wendet am 9. November 1914 erfolgreich eine mit Citratlösung haltbar gemachte Blutkonserve an. |
| 1915 | Richard Lewisohn vom Mount Sinai Hospital in New York verwendet erfolgreich Natriumcitrat als Gerinnungshemmer. Damit entfällt die Notwendigkeit, das Blut direkt vom Spender zum Empfänger zu übertragen. |
| 1925 | Karl Landsteiner entdeckt zusammen mit Phillip Levine 3 weitere Blutgruppen: N, M und P. |
| 1930er | Oehlecker-Probe, Verträglichkeitstest (mittlerweile außer Gebrauch) |
| 8. Dezember 1933 | Beginn des Blutspendewesens in Deutschland (Direkt-Transfusion mit der Beck’schen Mühle in Leipzig) |
| 1939/1940 | Das Rhesus(Rh)-Blutgruppensystem wird von Karl Landsteiner, Alexander Solomon Wiener, Philip Levine und Rufus E. Stetson entdeckt und als Ursache für die meisten negativen Reaktionen ausgemacht. Verlässliche Tests vermindern die negativen Reaktionen. |
| 1940 | Edwin Cohen entwickelt eine Methode, das Blutplasma in Fraktionen zu zerlegen. In der Folge wurde Albumin (erhöht den kolloidosmotischen Druck), Gammaglobulin (früherer Name für Antikörper) und Fibrinogen (Basis für Gerinnungsmittel wie Faktor VIII, stillt Blutungen) für die klinische Verwendung verfügbar. |
| Anfang der 1940er Jahre | Samuel Mitja Rapoport findet einen Zusatz, der die Haltbarkeit der Blutkonserve auf drei Wochen verlängert. |
| 1963 | Die erste intrauterine Bluttransfusion gelingt William Liley in Neuseeland. |
| 1985 | Die ersten HIV-Tests für Blutkonserven werden in den USA eingeführt. |
| 1987 | Zwei indirekte Tests auf Hepatitis B werden entwickelt und eingesetzt: Hepatitis-B-Core-Antigen-Test (Verzögerung Tage bis Wochen) und der Alaninaminotransferase (ALT)-Test, der jedoch frühestens 4 Wochen bis maximal 12 Wochen nach Infektion die erhöhte ALT erkennen kann. |
| 1990 | Der erste Test für Hepatitis C wurde eingeführt. |
| 1992 | Spenderblut wird auf HIV-1- und HIV-2-Antikörper getestet. |
| 1996 | Start der Tests auf das HIV-Antigen p24. Dies verbesserte und beschleunigte die Tests, da nun nicht mehr indirekt die Antikörper detektiert wurden, die erst 3–5 Wochen nach der Infektion nachgewiesen werden können, sondern ein spezielles Virus-Protein. |
| 1999 | Die Nukleinsäure-Amplifikations-Technik (NAT=PCR) wird implementiert. NAT kann direkt die genetischen Bestandteile von HCV und HIV feststellen. |
| 2001 | Die Leukozytendepletion wird verbindlich vorgeschrieben. |
| 2003 | Einführung des Predonation-Samplings. |
| 2005 | Anzucht von Hepatitis-C-Viren |
| Heute | … werden bei der Verträglichkeitsbestimmung bis zu 40 Merkmale und außerdem die für die Transplantat-Abstoßung verantwortlichen Gewebeantigene berücksichtigt. Es gibt 15 bis 19 bekannte Blutgruppen-Systeme. Es wurden über 400 bekannte Rote-Blutkörperchen-Antigene erkannt und charakterisiert. Im Rhesus-Blutgruppensystem können bis zu 300 Rhesusbluttypen theoretisch erkannt werden. |
Bluttransfusion bei Tieren
Katzen
Bei Katzen kann eine Bluttransfusion bei starken Blutverlusten oder Anämien anderer Ursache, wie beispielsweise einer Felinen Neonatalen Isoerythrolyse oder einer Niereninsuffizienz erforderlich sein. Eine Blutgruppenbestimmung ist vor der Transfusion unbedingt erforderlich. Spendertiere sollten über 5 kg schwer, frei von Infektionskrankheiten und regelmäßig entwurmt sein. Der Hämatokrit sollte über 35 liegen. Das Blut wird aus der Vena jugularis externa entnommen, wozu meist eine Narkose notwendig ist. Die maximal entnommene Blutmenge sollte 11 ml/kg nicht überschreiten. Dem Empfängertier wird das Blut über die Vena cephalica zugeführt, bei sehr kleinen Katzen oder schwierigen Zugangsverhältnissen kann auch eine Übertragung in das Knochenmark des Oberschenkelknochens erfolgen.[49]
Siehe auch
- Antigen-Antikörper-Reaktion
- Fetofetales Transfusionssyndrom bei Zwillingen
- Verbluten
- Blutdoping
- Maschinelle Autotransfusion
Literatur
- Kretschmer, Gombotz, Rump: Transfusionsmedizin – Klinische Hämotherapie. Thieme, Stuttgart 2008, ISBN 978-3-13-145751-6.
- Egmont R. Koch, Irene Meichsner: BÖSES BLUT. Die Geschichte eines Medizin-Skandals. Hoffmann und Campe, Hamburg 1990/1993, ISBN 3-455-10312-X.
- C. N. Nemes: Vor- und Frühgeschichte der Transfusion bis 1900. (Kurzfassung; detaillierter siehe Teil 2 und Teil 3: Tabellarium), S. 1–65.
- Jost Benedum (†): Bluttransfusion. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 195 f.
- Robert Offner: Transfusionsmedizin. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. 2005, S. 1407 f.
- A. P. Vercillo, S. V. Durpey: Jehova’s witness and the transfusion of blood products. In: New York State Journal of Medicine. 1988, S. 493 f.
- N. S. Smith, D. E. Milov: Use of erythropoietin in Jehova’s witness children. In: Florida MA. Band 80, 1993, S. 103–105.
Weblinks
- Juni 3288.5437 geänderte Hämotherapie-Richtlinien 2007
- Meilensteine der Erforschung des menschlichen Blutes ( vom 11. Dezember 2009 im Internet Archive)
- Ethischer Codex der International Society of Blood Transfusion (ISBT) ( vom 27. September 2007 im Internet Archive) (PDF; 40 kB)
- Gefährliche Bluttransfusionen - Was hilft gegen das Risiko? Doku vom 30. Oktober 2017 in der ARD-Mediathek (Die betrifft-Dokumentation von Ulrike Gehring ist am 4. November 2016 in Berlin mit dem Film- und Fernsehpreis des Hartmannbundes ausgezeichnet worden.)
- Interdisziplinäre Arbeitsgemeinschaft für klinische Hämotherapie (IAKH)
- Rainer Seitz: Zwischenbilanz nach 10 Jahren Zuständigkeit des PEI. (PDF) Paul-Ehrlich-Institut, Langen
Einzelnachweise
- ↑ Frank Wahner: Die Aufklärung des Patienten - aus juristischer Sicht (mit Beispielen). (PDF; 241 kB) 40. Jahreskongress der DGTI – 18. September 2007.
- ↑ Use of blood products for elective surgery in 43 European hospitals. The Sanguis Study Group. In: Transfus Med. 4(4), 1994 Dec, S. 251–268. PMID 7889138
- ↑ Jonathan Huber, Simon J Stanworth, Carolyn Doree, Patricia M Fortin, Marialena Trivella: Prophylactic plasma transfusion for patients without inherited bleeding disorders or anticoagulant use undergoing non-cardiac surgery or invasive procedures. In: Cochrane Database of Systematic Reviews. 28. November 2019, doi:10.1002/14651858.CD012745.pub2.
- ↑ Lise J Estcourt, Reem Malouf, Carolyn Doree, Marialena Trivella, Sally Hopewell: Prophylactic platelet transfusions prior to surgery for people with a low platelet count. In: Cochrane Database of Systematic Reviews. 17. September 2018, doi:10.1002/14651858.CD012779.pub2.
- ↑ Lise J Estcourt, Reem Malouf, Sally Hopewell, Carolyn Doree, Joost Van Veen: Use of platelet transfusions prior to lumbar punctures or epidural anaesthesia for the prevention of complications in people with thrombocytopenia. In: Cochrane Database of Systematic Reviews. 30. April 2018, doi:10.1002/14651858.CD011980.pub3.
- ↑ Lise Estcourt, Simon Stanworth, Carolyn Doree, Sally Hopewell, Michael F Murphy: Prophylactic platelet transfusion for prevention of bleeding in patients with haematological disorders after chemotherapy and stem cell transplantation. In: Cochrane Database of Systematic Reviews. 16. Mai 2012, doi:10.1002/14651858.CD004269.pub3.
- ↑ Lise J. Estcourt, Simon J, Stanworth, Carolyn Doree, Sally Hopewell, Marialena Trivella: Comparison of different platelet count thresholds to guide administration of prophylactic platelet transfusion for preventing bleeding in people with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation. In: Cochrane Database of Systematic Reviews. 18. November 2015, doi:10.1002/14651858.CD010983.pub2.
- ↑ C. G. Schüttler, G. Caspari u. a.: Hepatitis C virus transmission by a blood donation negative in nucleic acid amplification tests for viral RNA. In: Lancet. 355 (9197), 1. Jan 2000, S. 41–42. PMID 10615893
- ↑ Paul-Ehrlich-Institut ordnet Hepatitis-E-Virus-Testung von Blutspenden an. In: aerzteblatt.de. 18. Juni 2018, abgerufen am 18. Februar 2024.
- ↑ Archivierte Kopie ( des vom 27. Juni 2019 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Aryeh Shander, Gregg P. Lobel, Mazyar Javidroozi: Transfusion practices and infectious risks. In: Expert Review of Hematology. Band 9, Nr. 6, 2. Juni 2016, ISSN 1747-4086, S. 597–605, doi:10.1586/17474086.2016.1164593, PMID 26959944.
- ↑ Viral Clearance Studies for the Biopharmaceutical Industry. In: BioProcess International. 17. Dezember 2019, abgerufen am 13. Juli 2021 (amerikanisches Englisch).
- ↑ Gustaf Edgren u. a.: Risk of cancer after blood transfusion from donors with subclinical cancer: a retrospective cohort study. In: The Lancet. Band 369, S. 1724–1730. PMID 17512857. Siehe auch: Tumorzellen im Spenderblut. In: wissenschaft.de. 19. Mai 2007, abgerufen am 8. September 2019.
- ↑ Lymphdrüsenkrebs häufiger nach Bluttransfusion. In: International Journal of Cancer, Band 125 (6), neu erschienen. Deutsches Krebsforschungszentrum Heidelberg, 16. September 2009, archiviert vom (nicht mehr online verfügbar) am 4. Mai 2016; abgerufen am 18. September 2009. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Bundesärztekammer im Einvernehmen mit dem Paul-Ehrlich-Institut: Richtlinie zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Richtlinie Hämotherapie). (PDF) Bundesärztekammer, 2017, archiviert vom (nicht mehr online verfügbar) am 14. Dezember 2020; abgerufen am 15. August 2019. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Pschyrembel Klinisches Wörterbuch. 256. Auflage, S. 1309–1310 „Plasmaersatzstoffe“.
- ↑ Journal of the American Medical Association. Band 246, Nr. 21, 27. November 1981, S. 2471–2472.
- ↑ Vgl. etwa R. Riegler: Probleme bei Verweigerung von Bluttransfusionen. In: Der Anaesthesist. Band 34, 1985, S. 55 ff.
- ↑ Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz – AMG). Stand 21. September 2005
- ↑ Transfusionsgesetz. Gesetz zur Regelung des Transfusionswesens
- ↑ Georg August Kraus: Kritisch-etymologisches medicinisches Lexikon, 3. Auflage, Verlag der Deuerlich- und Dieterichschen Buchhandlung, Göttingen 1844, S. 440 f. archive.org
- ↑ Offner (2005), S. 1407.
- ↑ a b Historie der Bluttransfusion (Seite nicht mehr abrufbar, festgestellt im April 2018. Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Jost Benedum †: Bluttransfusion. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 195 f.; hier: S. 195.
- ↑ Francesco Folli: Stadera medica. Florenz 1680.
- ↑ Barbara I. Tshisuaka: Folli, Francesco. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. Berlin / New York 2005, S. 408.
- ↑ Jost Benedum: Bluttransfusion. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. Berlin / New York 2005, S. 195–196, hier: S. 196.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 25.
- ↑ Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Geschichte der Medizin – Ansichten zur Ethik: Menschenversuch und Menschlichkeit. 25. April 2003, abgerufen am 22. August 2021.
- ↑ Axel W. Bauer: Die erste Bluttransfusion beim Menschen durch Jean-Baptiste Denis im Jahre 1667 aus medizinhistorischer Perspektive. In: Transfusionsmedizin. Band 8, 2018, S. 33–39.
- ↑ Fritz Povacz: Geschichte der Unfallchirurgie. Springer, 2000, S. 393.
- ↑ J. L. Prévost, J.-B. Dumas: Examen du sang et de son action dans les divers phénomènes de la vie. In: Ann. Chim. Band 18, (Paris) 1821, S. 280–297.
- ↑ Barbara I. Tshisuaka: Prévost, Jean Louis. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. 2005, S. 1182.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 20.
- ↑ Christoph Weißer: Guérin, Alphonse-Françoise-Marie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 515.
- ↑ André Müllerschön: NEUE METHODEN UND IHRE BEWÄHRUNG IN DER MILITÄRMEDIZIN DES ERSTEN WELTKRIEGES.
- ↑ Leonard Landois: Die Transfusion des Blutes. Leipzig 1875.
- ↑ Diana Daniel: Der Capillarblut-Transfusor. Eine Nichtwissensgeschichte der Bluttransfusion im 19. Jahrhundert. (PDF) Magisterarbeit. Humboldt-Universität, Berlin 2013.
- ↑ Ernst Kern: Sehen – Denken – Handeln eines Chirurgen im 20. Jahrhundert. ecomed, Landsberg am Lech 2000, ISBN 3-609-20149-5, S. 190.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 66.
- ↑ Ernst Kern: Sehen – Denken – Handeln eines Chirurgen im 20. Jahrhundert. ecomed, Landsberg am Lech 2000, ISBN 3-609-20149-5, S. 190.
- ↑ Franz Gesellius: Die Transfusion des Blutes. Eine historische, kritische und physiologische Studie. Eduard Hoppe, St. Petersburg 1873.
- ↑ Oscar Hasse: Die Lammblut-Transfusion beim Menschen. Erste Reihe: 31 eigene Transfusionen umfassend. Eduard Hoppe, St. Petersburg 1874.
- ↑ Diana Daniel: Der Capillarblut-Transfusor. Eine Nichtwissensgeschichte der Bluttransfusion im 19. Jahrhundert. (PDF) Magisterarbeit. Humboldt-Universität zu Berlin, Philosophische Fakultät III, 2013, Kapitel 3 Diskurswissen.
- ↑ Ernst Kern: Sehen – Denken – Handeln eines Chirurgen im 20. Jahrhundert. ecomed, Landsberg am Lech 2000, ISBN 3-609-20149-5, S. 190.
- ↑ Leonard Landois: Die Transfusion des Blutes. Versuch einer physiologischen Begründung nach eigenen Experimental-Untersuchungen. Mit Berücksichtigung der Geschichte, der Indicationen, der operativen Technik und der Statistik. F. C. W. Vogel, Leipzig 1875, S. 315.
- ↑ Karl Landsteiner: On individual differences in human blood. Nobel Lecture, 11. Dezember 1930. In: Scandinavian Journal of Immunology. 32, 1990, Nr. 1, S. 9–10.
- ↑ Loris Premuda: Adriano Sturli (1873–1964) als Forscher und Arzt. In: Christa Habrich, Frank Marguth, Jörn Henning Wolf (Hrsg.) unter Mitarbeit von Renate Wittern: Medizinische Diagnostik in Geschichte und Gegenwart. Festschrift für Heinz Goerke zum sechzigsten Geburtstag. München 1978 (= Neue Münchner Beiträge zur Geschichte der Medizin und Naturwissenschaften: Medizinhistorische Reihe. Band 7/8), ISBN 3-87239-046-5, S. 327–340, hier: S. 331–332.
- ↑ Michael Streicher: Bluttransfusion bei der Katze. In: Kleintiermedizin. Nr. 11/12, 2009, S. 329–331.
